Segurament has sentit alguna vegada sobre els vidres, és probable que en aquest punt la teva ment hagi visualitzat un diamant enorme, una ametista o un topazi. I certament, dins d'aquest grup també s'inclouen moltes de les conegudes "Pedres precioses", però un vidre no és una denominació que abasti netament l'àmbit de la joieria.
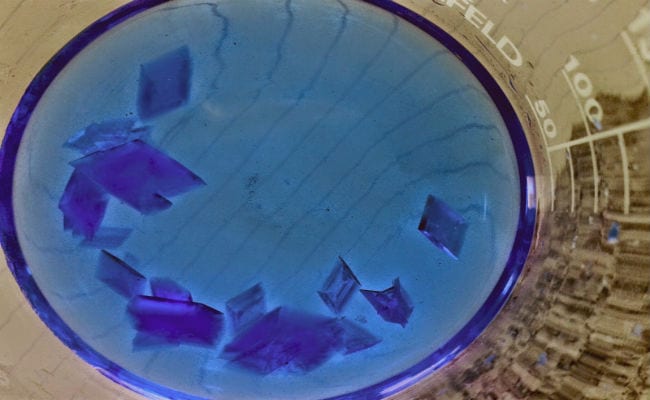
Un cristall és el producte final d'un interessant procés conegut com cristal·lització, el qual es caracteritza per resultar en un sòlid homogeni format per "cares", que són porcions situades en diversos plans.
Característiques de l'sòlid procedent de la cristal·lització
La mida d'un vidre és una característica variable, en un ampli rang de dimensions. Poden trobar-vidres "enormes" els quals poden ser mesurats a través de la unitat lineal "metro", així com també podem trobar vidres que han de ser expressats en termes de "micres", Ja que la seva mida petita els fa comparables amb microorganismes com els bacteris, els quals només són observables a través del microscopi.
Com s'ha esmentat, els processos cristal·lins deriven en productes d'alta puresa, per això vam establir, anteriorment en la definició, que els cristalls són homogenis: És a dir, la composició del producte es manté en un valor constant en qualsevol punt de l'volum de l'sòlid, el que també implica que les característiques físiques i químiques romanen inalterables en tota la peça, i en cas d'observar variació per causa d'una pertorbació , el canvi es produirà en tota l'espècie. Aquesta qualitat, fa dels vidres productes valuosos en diversos àmbits, que van des de l'apreciació de la qualitat de l'material, fins al ús de l'procés de cristal·lització com a tècnica per separar substàncies.
Els productes cristal·lins, també poden aïllar-se a nivell de laboratori, mitjançant reaccions controlades en muntatges que emulen els processos espontanis que tenen lloc a la natura. Una de les principals avantatges dels cristalls obtinguts en processos controlats, és que presenten formes més regulars, que calcen a la perfecció amb les figures poligonals de major exactitud.
En un cristall, cal distingir les cares que formen part de l'hàbit cristal·lí real (característiques morfològiques), i en base a el nombre d'elles, podem considerar les formes fonamentals de l'sòlid. En general en un vidre es troba definit per la combinació de diverses formes fonamentals, Sent les principals són les següents:
- pedió: Vidre constituït per una sola cara plana, sense equivalents.
- Pinacoide: Es constitueix de dues cares equivalents entre elles respecte a un eix de simetria.
- esfenoide: Les dues cares equivalents que conformen aquest sòlid es troben al voltant d'un eix binari.
- prisma: Està format per cares homòlogues que constitueixen una zona. Sent la "zona d'un vidre" definida com un conjunt de cares paral·leles a una mateixa direcció, corresponent a una aresta de la mateixa.
L'estructura dels cristalls des d'un punt de vista intern pot considerar-se que està constituïda per un sistema més o menys homogeni, periòdic i anisòtrop, d'un material dissolt que desenvolupa una estructura en diversos punts de l'espai. Dins de les característiques dels vidres, sempre ha despertat l'interès el fet que cada punt tingui una repetició periòdica en l'espai ocupat pel material. En cristal·lografia, el fenomen que influència aquesta acció es denomina translació.
Procés de cristal·lització
Perquè ocorri una cristal·lització, hem de partir d'una substància que pugui catalogar-se com "Cristal·lina", i això ve definit perquè les partícules que la conformen bé siguin de naturalesa atòmica, molecular o iònica, presenten propietats d'homogeneïtat, periodicitat i simetria.
Tot el procés s'activa quan en algun punt de la substància cristal·lina, les partícules comencen a reorganitzar-se, en una etapa que es coneix com nucleació. Tot aquest procés involucra, a més de l'evident variació en l'ordre de les partícules, un procés de canvi en les condicions termodinàmiques, les quals estan orientades a la compensació de les pertorbacions generades pel canvi en l'energia lliure de Gibbs, el qual està marcat per tres esdeveniments:
- El canvi en l'energia química.
- La creació d'una interfície entre la zona de la nucleació i la resta de la fase homogènia.
- La variació de l'volum i forma que involucra aquest procés, desencadena tensions.
La següent fase, s'origina, quan l'estructura base de la nucleació s'estabilitza. El pas següent, és una cosa lògica i predictible, un cop tenim l'estructura bàsica entrarem en un procés de Creixement, En el qual s'observa un canvi de les dimensions de l'nucli. A poc a poc, aquest augment es traduirà en la formació de cares, fins que el vidre adquireixi un hàbit ben definit.
Mecanisme de el creixement d'un cristall
La teoria desenvolupada per Volmer explica com es porta a terme el creixement d'un cristall, establint que, al voltant de l'estructura bàsica procedent de la nucleació de la substància cristal·lina, es desenvolupa una espècie de capa d'absorció, La qual actua com a interfície, i addicional a això promou una migració al voltant d'ella de partícules, que es mouen en forma paral·lela a la superfície. El resultat d'aquest procés es defineix com una estructura definida en un pla de dues dimensions.
Per la seva banda Kossel i Straski, van determinar que es requereix d'un treball mecànic per aconseguir la fixació d'un ió a la superfície d'aquesta capa, i que el mateix depèn de la seva posició.
El desenvolupament d'un model que defineixi el creixement, requereix de la previsió de zones de saturació on s'observa una major taxa de canvi (zones locals de sobresaturació). Això evidencia que el creixement de l'vidre passa per capes.
La cristal·lització com a mecanisme de separació
Atès que un vidre es forma amb una substància homogènia, s'ha estès el seu ús com a mètode de separació selectiva de substàncies, entre diversos mètodes, a continuació, explicarem en què consisteixen aquells l'ús és més estès:
- Addició d'un nou solvent: Si coneixem la naturalesa dels productes que estem manejant, podem aplicar aquest mètode, el qual consisteix bàsicament en l'addició d'un nou solvent que interactuï amb el solvent en el qual es troba immers el solut que desitgem que cristal·litzi. Quan el nou solvent, selectivament comença a interactuar amb el seu homòleg, el solut precipita, iniciant-se el procés de cristal·lització.
- Refredament a altes concentracions de solut: Quan tenim una solució d'alta concentració, que va ser elaborada a altes temperatures, i la sotmetem a un procés de refredament, obtenim una condició de sobresaturació, en la qual es té dissolta una major quantitat de solut que la que el solvent pot acceptar, en aquestes noves condicions de temperatura. Si el procés de reducció en la temperatura es fa en forma controlada, podem influir sobre la mida de l'vidre que obtindrem.
- sublimació: Aquesta tècnica només pot aplicar-se en compostos cristal·lins que presentin una elevada pressió de vapor, de tal manera que les transformacions des d'una fase gasosa a una sòlida, no requereixen el pas pel punt de fusió.