Hmota se skládá z malých částic, které jsou pro lidské oko neviditelné, které se nazývají atomy a molekuly, které jsou hlavními složkami toho, co dnes známe jako hmotu.
Výše uvedené částice jsou obvykle vstoupit do procesu lepení známého jako chemická vazba, a ty jsou studovány chemií, aby bylo možné pochopit tisíce biologických procesů, které se denně vyskytují před námi, ale které nelze snadno vnímat. Právě skrze ně dokázali pochopit většinu událostí, díky nimž je svět takový, jaký je.
Co jsou to chemické vazby?

Všechny existující věci na světě, včetně živých bytostí, mezi nimiž jsou lidské bytosti, jsou tvořeny spojením některých atomů a molekul, které se rozhodnou spojit prostřednictvím procesu známého jako chemická vazba. Je dobře známo, že všechny živé organismy a dokonce i inertní (neživé objekty) jsou tvořeny hmotou, což závisí na chemických vazbách, aby se mohly samy vytvořit.
V závislosti na tom, jak jsou atomy a molekuly spojeny, je možné určit, jaký typ chemické vazby se zpracovává, a mezi nejběžnějšími lze najít iontové, kovalentní a kovové vazby, ačkoli byly nalezeny dva typy vazeb. vazby, které nejsou příliš známé, když mluvíme o subjektu, což jsou vazby vodíkových můstků a Van der Waals.
Chemické vazby se nazývají síly, díky nimž dva nebo více atomů zůstávají po určitou dobu pohromadě a které umožňují přenos elektronů mezi nimi.
Proces přitažlivosti, ke kterému dochází mezi dvěma atomy, se změní na něco trochu zvláštního, ale pokud je analyzován s malou pozorností, lze jej snadno pochopit. Hlavní věc, kterou je třeba vědět, je, že jádra, která mají kladné náboje, se vzdalují, ale zároveň je lze přitahovat díky záporně nabitým elektronům, které jsou na jejich povrchu, což může být při několika příležitostech větší než síla, kterou způsobuje jádra se vzdálit.
Když k procesu chemické vazby dochází obvykle, ne-li po celou dobu některé atomy ztrácejí elektrony zatímco ostatní vyhrávají, ale na konci procesu lze u všech akcí pozorovat elektrickou stabilitu.
5 typů chemických vazeb
Chemické vazby a některé z jejich charakteristik budou uvedeny níže, aby bylo pochopeno, jak fungují.

Kovové odkazy
Na tomto typu vazby můžete vidět, jak se vytváří mrak, který drží pohromadě celou sadu atomů, kterou tvoří volné elektrony. V tomto procesu lze pozorovat, jak se atomy transformují na elektrony a ionty, místo aby se odehrály tak, jak by to za normálních okolností bylo, a zanechaly sousední atom.
Kovové vazby obvykle tvoří sítě považované za krystalické, které mají vysoký index koordinace.
Na tvářích těchto sítí můžete vidět tři různé typy krystalických sítí, které mají různé koordinační body, které se mění v závislosti na tom, kde se nacházejí, dosahující 12 bodů, 8 bodů a poslední se 6 body, avšak Nicméně se říká, že valenční úroveň atomů kovů je vždy malá.
Iontové vazby
Když mluvíme o iontových vazbách, chceme se zmínit o spojení mezi atomy, které mají malou elektrostatickou energii, s těmi, které mají energii stejného typu větší než ty první, kterými jsou obvykle kovový prvek a nekovový prvek . K tomu je nutné, aby jeden z atomů mohl ztratit elektrony a ten druhý je mohl postupně získat. Tuto vazbu tedy lze popsat jako proces, při kterém mají dva atomy elektrostatickou přitažlivost, přičemž jeden se účastní s větší přitažlivostí a druhý s menší přitažlivostí.
Ukázalo se, že nekovové prvky postrádají elektron ve svém složení, aby mohly mít svoji úplnou oběžnou dráhu, a z tohoto důvodu se stává přijímačem procesu, který se nazývá anion.
Kovové prvky jsou známé jako kationty, protože mají kladný náboj, který je opakem aniontů, a protože mají elektron ve svém posledním složení, mají schopnost vázat se na další atomy, v tomto případě nekovové.
Na základě toho, co bylo popsáno, lze odvodit, že v tomto typu chemické vazby jsou atomy přitahovány elektrostatickou silou, a proto anion přitahuje kation, a je zde, když je možné pozorovat, když se jeden z atomů získá zatímco druhý absorbuje. Když tato sloučenina zůstane pevná, zůstane tak, jak je popsáno, a stabilní, ale v přesný okamžik je umístěna ve vlhkém prostředí nebo standardně v nějaké kapalině, znovu by se oddělily a udržovaly své elektrické náboje.
Kovalentní vazby
V kovalentních vazbách mají atomy schopnost přitahovat a sdílet elektrony nebo je absorbovat jako ve výše uvedených případech a bylo prokázáno, že když k nim dojde, jsou ionty mnohem stabilnější.
I když lze říci, že většina spojů má kapacitu být vodiči elektřiny, ale v tomto případě se ukázalo, že velká část není. Veškerá organická hmota je tvořena kovalentními vazbami, protože jak je uvedeno výše, je mnohem stabilnější.
Tyto vazby mají své vlastní dělení, které se liší v závislosti na tom, zda se jedná o čistou směs či nikoli, kterým se říká polární vazby a nepolární vazby, jejichž stručné vysvětlení bude uvedeno níže.
Polární kovalentní vazba
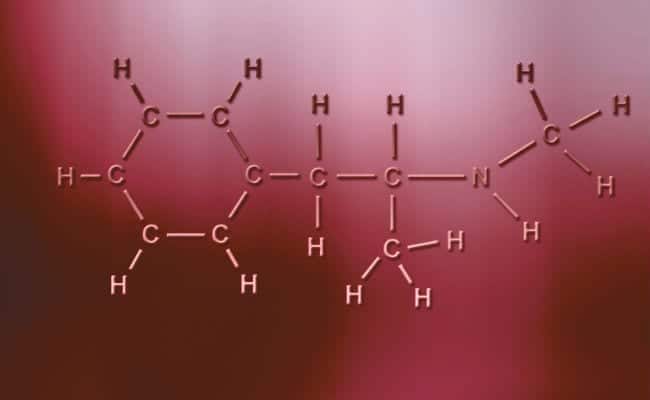
Hlavní charakteristikou polárních kovalentních vazeb je to, že jsou zcela asymetrické, v tom smyslu, že atomy s kladným nebo záporným nábojem mohou mít dva sdílené elektrony nebo dva mezery, které absorbují, zatímco druhý má pouze jeden, který mění případy. Dochází k nim prakticky stejně jako iontové vazby, ale pouze s tím rozdílem, že pro spojení atomů dochází k polární kovalentní vazbě. Aby k nim mohlo dojít, musí nastat mezi dvěma zcela odlišnými nekovovými prvky,
Nepolární kovalentní vazba
Na rozdíl od výše popsaného typu chemické vazby v tomto případě musí existovat dva nebo více atomů nekovu stejného typu. To je zcela odlišné od polárního ve všech směrech a to lze prokázat vědomím, že když dva atomy stejného prvku sdílejí elektrony, protože proces je zcela symetrický, zůstávají vyvážené a oba přijímají a darují elektrony stejně.
Vodíkové vazby
Vodík je charakterizován tím, že má vždy kladný náboj, a aby bylo možné tuto vazbu provést, je nutné, aby byl přitahován atomem s elektronegativním nábojem, který díky tomuto procesu umožňuje pozorovat, jak se vytváří unie mezi dva v jednom, který byl denominován jako vodíkový můstek, odkud je odvozen název vazby.
Odkazy na Van der Waals
V tomto typu vazeb lze nalézt spojení mezi dvěma permanentními dipóly, stejně jako mezi dvěma indukovanými dipóly, nebo může existovat možnost, že budou nalezeny unie mezi trvalým a indukovaným dipólem. Jediným způsobem, jak toho dosáhnout, je mezi dvěma symetrickými molekulami, které začnou působit, když mezi molekulami dojde k přitahování nebo odpuzování nebo standardně k interakci mezi ionty a molekulami.
Díky neustálému studiu platí pro všechny typy existujících chemických vazeb je, že bylo možné trochu více pochopit, jak hmota funguje a jak ji lze přeměnit na zcela nový produkt nebo se vrátit do svého tvaru po změně akce elektronové výměny, jak je popsáno ve většině těchto procesů.
Všechny tyto znalosti byly dosaženy díky pokroku technologie, protože dříve se pouze spekulovalo o existenci atomů a příkladem toho je existence atomových modelů velkých filozofických myslitelů, i když nebyli tak daleko od toho, co je dnes známé, dnes bylo možné procesům lépe porozumět.