Aine koosneb väikestest inimsilmale nähtamatutest osakestest, mida nimetati aatomiteks ja molekulideks, mis on peamised komponendid sellele, mida me tänapäeval mateeriana tunneme.
Eelnimetatud osakesed on tavaliselt sisestage keemiline sidumineja neid uurib keemia, et mõista tuhandeid bioloogilisi protsesse, mis toimuvad iga päev meie ees, kuid mida ei saa hõlpsasti tajuda. Nende kaudu on mõistetud enamikku sündmustest, mis muudavad maailma selliseks, nagu see on.
Mis on keemilised sidemed?

Kõik maailmas eksisteerivad asjad, sealhulgas elusolendid, nende seas ka inimesed, koosnevad mõnede aatomite ja molekulide ühendusest, mis otsustavad ühineda keemilise sidemena tuntud protsessi kaudu. On hästi teada, et kõik elusorganismid ja isegi inertsed (elutud objektid) koosnevad ainest ja see sõltub keemilistest sidemetest, et end ise luua.
Sõltuvalt aatomite ja molekulide ühendamise viisist on võimalik kindlaks teha, millist tüüpi keemilist sidet töödeldakse, ja kõige tavalisemate seast võib leida ioonseid, kovalentseid ja metallilisi sidemeid, ehkki kahte tüüpi uusi sidemeid, mis pole eriti hästi teada, kui tegemist on subjektiga, milleks on vesinikusillad ja Van der Waals.
Keemilisteks sidemeteks nimetatakse neid jõude, mis panevad kaks või enam aatomit teatud ajaks koos püsima ja võimaldavad nende vahel elektrone edastada.
Kahe aatomi vahel toimuv külgetõmbeprotsess muutub millekski pisut kummaliseks, kuid kui seda vähese tähelepanuga analüüsida, saab sellest väga lihtsalt aru. Peamine asi on teada, et positiivsete laengutega tuumad eemalduvad, kuid samal ajal võivad nad meelitada tänu nende pinnal asuvatele negatiivse laenguga elektronidele, mis võivad mitmel korral olla suuremad kui jõud, mida see tekitab. põhjustab tuumade eemaldumist.
Kui keemiline sidumisprotsess toimub tavaliselt, kui mitte kogu aeg mõned aatomid kaotavad elektrone samal ajal kui teised võidavad, kuid protsessi lõpus võib kõigi toimingute seas täheldada elektrilist stabiilsust.
5 tüüpi keemilisi sidemeid
Keemilised sidemed ja mõned nende omadused on toodud allpool, et mõista nende toimimist.

Metallist lingid
Seda tüüpi sidemetes näete, kuidas tekib pilv, mis hoiab koos kogu aatomite komplekti, mille moodustavad lahtised elektronid. Selles protsessis võib täheldada, kuidas aatomid muundatakse elektronideks ja ioonideks, selle asemel, et juhtuda nii, nagu see tavaliselt oleks, jättes külgneva aatomi.
Metallilised sidemed moodustavad tavaliselt kristallilisteks peetavad võrgud, millel on kõrge koordinatsiooni indeks.
Nende võrkude nägudel näete kolme erinevat tüüpi kristallvõrke, millel on erinevad koordineerimispunktid, mis muutuvad sõltuvalt nende asukohast, ulatudes 12, 8 ja viimasele 6 punktiga, ilma et öeldakse, et metalli aatomite valentsitase on alati väike.
Ioonilised sidemed
Ioonilistest sidemetest rääkides tahame viidata vähese elektrostaatilise energiaga aatomite ühendamisele nendega, millel on sama tüüpi energia kui esimestel, mis on tavaliselt metalliline ja mittemetalliline element . Selle juhtumiseks on vajalik, et üks aatomitest kaotaks elektrone ja teine neid järjest. Seetõttu saab seda sidet kirjeldada protsessina, kus kahel aatomil on elektrostaatiline külgetõmme, milles üks osaleb suurema ja teine vähem atraktiivsusega.
Näidati, et mittemetalliliste elementide koostises puudub elektron, et oleks võimalik kogu nende orbiit ja seetõttu saab sellest protsessi vastuvõtja, mida nimetatakse aniooniks.
Metallilisi elemente tuntakse katioonidena, kuna neil on positiivne laeng, mis on vastupidine anioonidele, ja kuna nende koostises on viimane elektron, on neil võime seonduda teiste aatomitega, antud juhul mittemetallidega.
Kirjeldatust lähtudes võib järeldada, et seda tüüpi keemilise sideme korral tõmbab aatomeid elektrostaatiline jõud ja seetõttu meelitab anioon katiooni ja see on seal, kui on võimalik jälgida, kui üks aatomitest annab samal ajal kui teine neelab. Kui see ühend jääb tahkeks, jääb see kirjeldatuks ja stabiilseks, kuid täpselt sel hetkel, kui see asetatakse niiskesse keskkonda või vaikimisi mõnes vedelikus, eralduksid nad uuesti, säilitades oma elektrilaengud.
Kovalentsed sidemed
Kovalentsete sidemete korral on aatomitel võime meelitada ja jagada elektrone või neid neelata nagu ülalnimetatud juhtudel, ning on näidatud, et nende tekkimisel on ioonid palju stabiilsemad.
Kuigi võib öelda, et enamikul linkidel on võime olla elektrijuhid, kuid sel juhul selgub, et suur osa mitte. Kogu orgaaniline aine koosneb kovalentsetest sidemetest, kuna nagu eespool mainitud, on see palju stabiilsem.
Nendel sidemetel on oma jaotus, mis varieerub sõltuvalt sellest, kas tegemist on puhta seguga või mitte, mida on nimetatud polaarseteks sidemeteks ja mittepolaarseteks, millele järgnevalt antakse lühike selgitus.
Polaarne kovalentne side
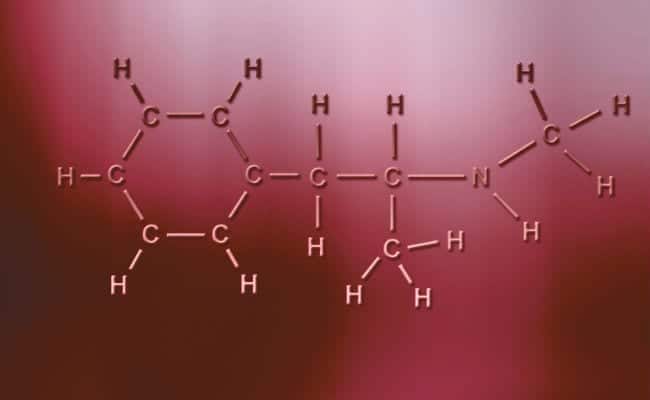
Polaarsete kovalentsete sidemete peamine omadus on see, et nad on täiesti asümmeetrilised selles mõttes, et positiivse või negatiivse laenguga aatomitel võib olla kaks elektroni jagamiseks või kaks ruumi neeldumiseks, samal ajal kui teisel on ainult üks, muutes juhtumeid. Need toimuvad praktiliselt samamoodi kui ioonsidemed, kuid ainsa erinevusega, et aatomite ühinemiseks tekib polaarne kovalentne side. Nende toimumiseks peavad need toimuma kahe täiesti erineva mittemetallilise elemendi vahel,
Mittepolaarne kovalentne side
Erinevalt ülalkirjeldatud keemilise sideme tüübist peab sel juhul olema kaks või enam sama tüüpi mittemetalli aatomit. See erineb igas mõttes täielikult polaarsest ja seda saab tõestada teadmisega, et kui kaks sama elemendi aatomit jagavad elektrone, kuna protsess on täiesti sümmeetriline, jäävad nad tasakaalus ning mõlemad võtavad vastu ja annetavad elektrone võrdselt.
Vesiniksidemed
Vesinikku iseloomustab alati positiivse laengu olemasolu ja selle sideme täitmiseks on vajalik, et seda tõmbaks elektronegatiivse laenguga aatom, mis tänu sellele protsessile on võimalik jälgida, kuidas mõlema vahel tekib liit see, mis oli tähistatud nagu vesinikusild, kust sideme nimi tuleneb.
Seosed Van der Waalsiga
Seda tüüpi linkides võib leida kahe püsiva dipooli vahelise ühenduse, samuti kahe indutseeritud dipooli vahel, või võib olla võimalus, et püsiva ja indutseeritud dipooli vahel leitakse liit. Ainus viis selle saavutamiseks on kahe sümmeetrilise molekuli vahel, mis hakkavad toimima siis, kui molekulide vahel on tõmme või tõrjumine või vaikimisi ioonide ja molekulide vastasmõju.
Tänu pidevale õppimisele, mis kehtib kõigi olemasolevate keemiliste sidemete tüüpide kohta on see, et on olnud võimalik veidi rohkem aru saada, kuidas mateeria töötab ja kuidas seda saab muuta täiesti uueks tooteks või taastada oma kuju pärast elektronivahetuse toimel muutumist, nagu on kirjeldatud enamikus nendes protsessides.
Kõik need teadmised on saavutatud tänu tehnoloogia arengule, kuna varem spekuleeriti ainult aatomite olemasolu üle ja selle näiteks on suurte filosoofiliste mõtlejate aatomimudelite olemasolu, ehkki need ei olnud nii kaugel sellest, mis on Tänapäeval on olnud võimalik protsesse paremini mõista.