The 50 best phrases of Friedrich Nietzsche
Friedrich Nietzsche is without a doubt one of the most important and influential philosophers and thinkers of all…

Friedrich Nietzsche is without a doubt one of the most important and influential philosophers and thinkers of all…

Schizophrenia is a mental disorder that affects a significant part of the world's population. For years schizophrenia...

Depressive realism is an artistic and literary trend that arises as a reaction to excessive optimism...

Sleeping optimally is essential when it comes to enjoying certain physical and mental well-being. Without…

Cortisol is popularly known as the stress hormone and will play a fundamental role and...

Agoraphobia is an anxiety-related disorder characterized by an intense fear of finding oneself in situations…
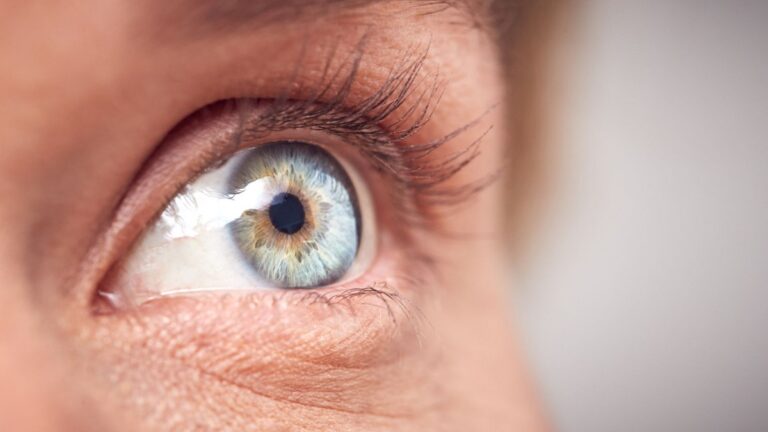
Bálint Syndrome is a rare neurological disease that will affect visual perception and…

Concepts such as solidarity or social justice seem foreign to the world of economics and finance. EthicHub is coming…

Violence and abuse is something that is unfortunately constantly present in today's society...

Start by closing your eyes and visualizing last summer's beach vacation. It is normal that you are capable...

Psychotic breaks represent a very complex mental phenomenon, which is disconcerting both for the person who suffers from them and...