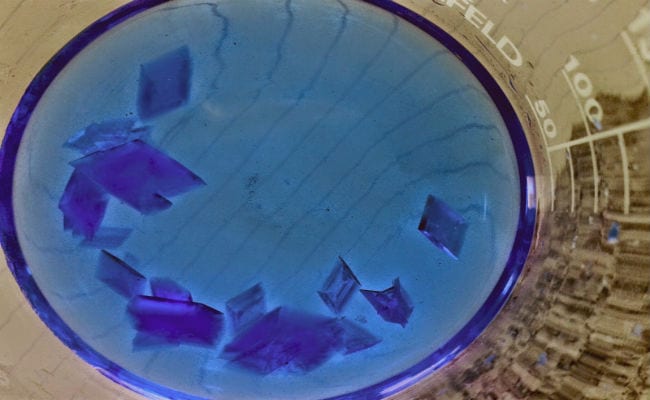
Je hebt vast wel eens van kristallen gehoord, het is waarschijnlijk dat je geest op dit punt een enorme diamant, een amethist of een topaas heeft gevisualiseerd. En zeker, deze groep omvat ook veel van de bekende "Edelstenen", maar een kristal is geen denominatie die duidelijk het gebied van sieraden omvat.
Een kristal is het eindproduct van een interessant proces dat bekend staat als kristallisatie, dat wordt gekenmerkt doordat het resulteert in een homogene vaste stof die wordt gevormd door "vlakken", dit zijn delen die zich in verschillende vlakken bevinden.
Kenmerken van de vaste stof door kristallisatie
De grootte van een kristal is een variabel kenmerk, in een breed scala aan afmetingen. "Enorme" kristallen kunnen worden gevonden die kunnen worden gemeten door middel van de lineaire eenheid "meter", evenals vind kristallen dat moet zijn uitgedrukt in termen van ‘micron’, omdat ze door hun kleine formaat vergelijkbaar zijn met micro-organismen zoals bacteriën, die alleen door de microscoop waarneembaar zijn.
Zoals gezegd resulteren kristallijne processen in producten met een hoge zuiverheid, daarom hebben we dat eerder in de definitie vastgesteld de kristallen zijn homogeen: dat wil zeggen dat de samenstelling van het product op elk punt in het volume van de vaste stof op een constante waarde blijft, wat ook inhoudt dat de fysische en chemische eigenschappen gedurende het hele stuk onveranderd blijven, en in het geval dat er variatie wordt waargenomen als gevolg van een storing, de verandering zal door de soort heen plaatsvinden. Deze kwaliteit maakt kristallen waardevolle producten op verschillende gebieden, variërend van de waardering van de kwaliteit van het materiaal tot de gebruik van het kristallisatieproces als techniek om stoffen te scheiden.
Kristallijne producten kunnen ook op laboratoriumniveau worden geïsoleerd, door middel van gecontroleerde reacties in assemblages die de spontane processen nabootsen die in de natuur plaatsvinden. Een van de belangrijkste voordelen van de kristallen die in gecontroleerde processen worden verkregen, is dat ze meer regelmatige vormen vertonen, die perfect passen bij de veelhoekige figuren met een grotere nauwkeurigheid.
In een kristal moeten we de gezichten onderscheiden die deel uitmaken van de echte kristallijne gewoonte (morfologische kenmerken), en op basis van het aantal kunnen we de fundamentele vormen van de vaste stof beschouwen. Meestal in een kristal wordt bepaald door de combinatie van verschillende fundamentele vormen, waarvan de belangrijkste de volgende zijn:
- Pedion: Glas bestaande uit een enkele vlakke zijde, zonder equivalenten.
- Pinacoid: Het bestaat uit twee gelijkwaardige vlakken ten opzichte van een symmetrieas.
- Wiggenbeen: De twee equivalente vlakken waaruit deze vaste stof bestaat, liggen rond een binaire as.
- Prisma: Het bestaat uit homologe gezichten die een zone vormen. Het "gebied van een kristal" zijn, gedefinieerd als een reeks vlakken evenwijdig aan dezelfde richting, corresponderend met een rand daarvan.
De structuur van kristallen vanuit een intern standpunt kan worden beschouwd als gevormd door een min of meer homogeen, periodiek en anisotroop systeem van een opgelost materiaal dat op verschillende punten in de ruimte een structuur ontwikkelt. Binnen de eigenschappen van de kristallen is er altijd interesse gewekt door het feit dat elk punt regelmatig herhalen in de ruimte die wordt ingenomen door het materiaal. In kristallografie wordt het fenomeen dat deze actie beïnvloedt, genoemd vertaling.
Kristallisatieproces
Om kristallisatie te laten plaatsvinden, moeten we uitgaan van een stof die kan worden geclassificeerd als "Kristallijn", en dit wordt gedefinieerd omdat de deeltjes waaruit het bestaat, of ze nu van atomaire, moleculaire of ionische aard zijn, eigenschappen hebben van homogeniteit, periodiciteit en symmetrie.
Het hele proces wordt geactiveerd wanneer op een bepaald punt in de kristallijne substantie de deeltjes beginnen te reorganiseren, in een stadium dat bekend staat als nucleatie. Dit hele proces omvat, naast de duidelijke variatie in de volgorde van de deeltjes, een proces van verandering in de thermodynamische omstandigheden, die gericht zijn op de compensatie van de verstoringen die worden gegenereerd door de verandering in de vrije energie van Gibbs, die wordt gekenmerkt door drie evenementen:
- De verandering in chemische energie.
- Het creëren van een interface tussen de nucleatiezone en de rest van de homogene fase.
- De variatie in volume en vorm die dit proces met zich meebrengt, roept spanningen op.
De volgende fase begint, wanneer de structuur van de nucleatiebasis stabiliseert. De volgende stap is iets logisch en voorspelbaar, als we eenmaal de basisstructuur hebben, gaan we een proces in van groei, waarbij een verandering in de afmetingen van de kern wordt waargenomen. Beetje bij beetje zal deze toename resulteren in de vorming van gezichten, totdat het kristal een goed gedefinieerde gewoonte krijgt.
Mechanisme van kristalgroei
De door Volmer ontwikkelde theorie legt uit hoe de groei van een kristal plaatsvindt, waarbij wordt vastgesteld dat, rond de basisstructuur van de nucleatie van de kristallijne substantie, een soort absorptielaag, dat fungeert als een interface, en daarnaast bevordert het een migratie van deeltjes eromheen, die evenwijdig aan het oppervlak bewegen. Het resultaat van dit proces wordt gedefinieerd als een structuur die is gedefinieerd in een tweedimensionaal vlak.
Dat bepaalden Kossel en Straski van hun kant mechanisch werk is vereist om de fixatie van een ion aan het oppervlak van deze laag te bereiken, en dat het afhangt van zijn positie.
De ontwikkeling van een model dat groei definieert, vereist de voorspelling van verzadigingszones waar een hogere mate van verandering wordt waargenomen (lokale zones van oververzadiging). Dit toont aan dat kristalgroei in lagen plaatsvindt.
Kristallisatie als scheidingsmechanisme
Omdat een kristal wordt gevormd met een homogene substantie, is het gebruik ervan als een methode voor selectieve scheiding van substanties uitgebreid, onder verschillende methoden, hieronder zullen we uitleggen wat degenen zijn waarvan het gebruik meer wijdverbreid is, bestaan uit:
- Een nieuw oplosmiddel toevoegen: Als we de aard kennen van de producten die we hanteren, kunnen we deze methode toepassen, die in feite bestaat uit het toevoegen van een nieuw oplosmiddel dat in wisselwerking staat met het oplosmiddel waarin de opgeloste stof die we willen kristalliseren is ondergedompeld. Wanneer het nieuwe oplosmiddel selectief begint te interageren met zijn homoloog, slaat de opgeloste stof neer en start het kristallisatieproces.
- Koelen tot hoge concentraties opgeloste stof: Als we een oplossing met een hoge concentratie hebben, die is gemaakt bij hoge temperaturen, en we deze onderwerpen aan een afkoelingsproces, krijgen we een toestand van oververzadiging, waarin een grotere hoeveelheid opgeloste stof wordt opgelost dan het oplosmiddel kan accepteren, in die nieuwe temperatuur condities. Als het proces van het verlagen van de temperatuur op een gecontroleerde manier gebeurt, kunnen we de grootte van het kristal dat we gaan verkrijgen beïnvloeden.
- Sublimatie: Deze techniek kan alleen worden toegepast in kristallijne verbindingen met een hoge dampspanning, zodanig dat de omzettingen van een gasfase naar een vaste fase geen doorgang door het smeltpunt vereisen.