Lënda përbëhet nga grimca të vogla që janë të padukshme për syrin e njeriut, të cilat quheshin atome dhe molekula që janë përbërësit kryesorë të asaj që ne e njohim sot si lëndë.
Grimcat e lartpërmendura janë zakonisht hyjnë në një proces bashkimi të njohur si lidhje kimike, dhe këto studiohen nga kimia në mënyrë që të kuptohen mijëra procese biologjike që ndodhin çdo ditë para nesh, por që nuk mund të perceptohen lehtë. Throughshtë përmes tyre që ata kanë arritur të kuptojnë shumicën e ngjarjeve që e bëjnë botën ashtu siç është.
Cilat janë lidhjet kimike?

Të gjitha gjërat ekzistuese në botë, duke përfshirë qeniet e gjalla, ndër të cilat janë qenie njerëzore, përbëhen nga bashkimi i disa atomeve dhe molekulave që vendosin të bashkohen përmes një procesi të njohur si një lidhje kimike. Dihet mirë se të gjithë organizmat e gjallë dhe madje edhe ato inerte (sende të pajetë) përbëhen nga materia, dhe kjo varet nga lidhjet kimike që të krijohet vetë.
Në varësi të mënyrës së bashkimit të atomeve dhe molekulave, është e mundur të përcaktohet se çfarë lloji i lidhjes kimike po trajtohet, dhe ndër ato më të zakonshmet mund të gjenden lidhje jonike, kovalente dhe metalike, megjithëse dy lloje të lidhjeve të reja që nuk janë shumë i njohur mirë kur bëhet fjalë për temën, të cilat janë lidhjet e urës së hidrogjenit dhe Van der Waals.
Lidhje kimike quhen ato forca që bëjnë dy ose më shumë atome të qëndrojnë së bashku për një kohë të caktuar, dhe që lejojnë transmetimin e elektroneve midis tyre.
Procesi i tërheqjes që ndodh midis dy atomeve shndërrohet në diçka pak të çuditshme, por nëse analizohet me pak vëmendje, mund të kuptohet shumë lehtë. Gjëja kryesore për të ditur është se bërthamat që kanë ngarkesa pozitive largohen, por në të njëjtën kohë ato mund të tërhiqen falë elektroneve të ngarkuara negativisht që janë në sipërfaqen e tyre, të cilat në disa raste mund të jenë më të mëdha se forca që shkakton bërthamat të largohen.
Kur procesi i lidhjes kimike ndodh zakonisht, nëse jo gjatë gjithë kohës disa atome humbin elektronet ndërsa të tjerët po fitojnë, por në fund të procesit mund të vërehet një qëndrueshmëri elektrike midis gjithë veprimit.
5 llojet e lidhjeve kimike
Lidhjet kimike dhe disa nga karakteristikat e tyre do të tregohen më poshtë për të kuptuar se si funksionojnë.

Lidhje metalike
Në këtë lloj lidhje mund të shihni se si krijohet një re që mban të gjithë bashkësinë e atomeve, e cila formohet nga elektronet e lirshme. Mund të vërehet në këtë proces se si atomet transformohen në elektrone dhe jone, në vend që të ndodhin siç do të ndodhnin normalisht, duke lënë një atom ngjitur.
Lidhjet metalike zakonisht formojnë rrjete të konsideruara kristalore, të cilat kanë një indeks të lartë koordinimi.
Në fytyrat e këtyre rrjeteve mund të shihni tre lloje të ndryshme të rrjeteve kristalore, të cilat kanë pika të ndryshme koordinimi që ndryshojnë në varësi të vendit ku ndodhen, duke arritur 12 pikë, 8 pikë dhe e fundit me 6 pikë, pa Sidoqoftë, thuhet se niveli i valencës së atomeve të metaleve është gjithmonë i vogël.
Lidhjet Jonike
Kur flasim për lidhje jonike, duam t'i referohemi bashkimit midis atomeve që kanë pak energji elektrostatike me ato që kanë një energji të llojit të njëjtë më të madh se ato të parat, të cilat zakonisht janë një element metalik dhe një element jo metalik . Që të ndodhë kjo është e nevojshme që njëri prej atomeve të mund të humbasë elektronet, dhe tjetri t'i fitojë ato radhazi. Prandaj, kjo lidhje mund të përshkruhet si një proces në të cilin dy atome kanë një tërheqje elektrostatike, në të cilën njëri merr pjesë me tërheqje më të madhe dhe tjetri me më pak tërheqje.
U tregua se elementëve jometalikë nuk kanë një elektron në përbërjen e tyre për të qenë në gjendje të kenë orbitën e tyre të plotë dhe për këtë arsye bëhet një marrës i procesit, i cili quhet anion.
Elementet metalikë njihen si katione sepse kanë një ngarkesë pozitive që është e kundërta e anioneve, dhe meqenëse kanë një elektron në pjesën e fundit të përbërjes së tyre, ata kanë aftësinë të lidhen me atomet e tjerë, në këtë rast ato jometalikë.
Të udhëhequr nga ajo që është përshkruar, mund të konkludohet se në këtë lloj lidhje kimike atomet tërhiqen nga një forcë elektrostatike, dhe për këtë arsye anioni tërheq kationin, dhe kjo është kur mund të vërehet kur njëri prej atomeve jep ndërsa tjetri thith. Kur kjo përbërje mbetet e ngurtë, ajo mbetet siç përshkruhet dhe e qëndrueshme, por në momentin e saktë vendoset në një mjedis të lagësht ose në mënyrë të paracaktuar në ndonjë lëng, ato do të ndahen përsëri, duke ruajtur ngarkesat e tyre elektrike.
Lidhjet kovalente
Në lidhjet kovalente, atomet kanë aftësinë të tërheqin dhe ndajnë elektronet ose t'i thithin ato si në rastet e përmendura më lart, dhe është treguar se kur këto ndodhin jonet janë shumë më të qëndrueshme.
Megjithëse mund të thuhet se shumica e lidhjeve kanë një kapacitet të jenë përcjellës të energjisë elektrike, por në këtë rast rezulton se një pjesë e madhe nuk është. E gjithë lënda organike përbëhet nga lidhje kovalente, pasi siç u përmend më lart ajo është shumë më e qëndrueshme.
Këto lidhje kanë ndarjen e tyre që ndryshon në varësi të faktit nëse është një përzierje e pastër apo jo, të cilat janë quajtur lidhje polare dhe lidhje jopolare prej të cilave do të jepet një shpjegim i shkurtër më poshtë.
Lidhje kovalente polare
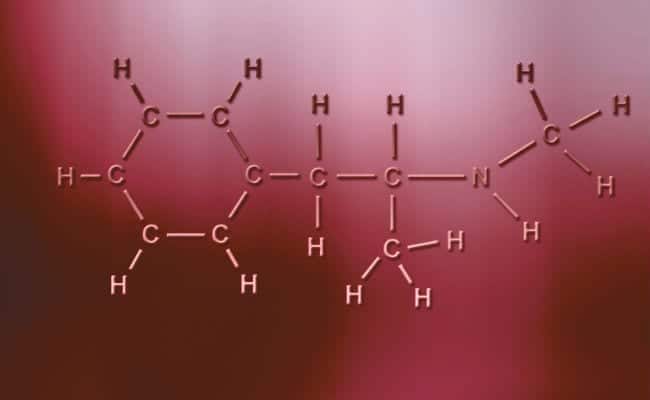
Karakteristika kryesore e lidhjeve kovalente polare është se ato janë krejtësisht asimetrike, në kuptimin që atomet me një ngarkesë pozitive ose negative mund të kenë dy elektrone për të ndarë ose dy hapësira për të thithur ndërsa tjetra ka vetëm një, duke ndryshuar rastet. Këto ndodhin praktikisht njësoj si lidhjet jonike, por me ndryshimin e vetëm që për bashkimin e atomeve, ndodh një lidhje kovalente polare. Që të ndodhin këto, ato duhet të ndodhin midis dy elementeve jometalikë krejtësisht të ndryshëm,
Lidhje kovalente jopolare
Ndryshe nga lloji i lidhjes kimike të përshkruar më sipër, në këtë rast duhet të ketë dy ose më shumë atome të një jometali të të njëjtit lloj. Kjo është krejtësisht e ndryshme nga polari në çdo mënyrë, dhe kjo mund të demonstrohet duke ditur se kur dy atome të të njëjtit element ndajnë elektronet pasi procesi është krejtësisht simetrik, ata mbeten të ekuilibruar dhe të dy marrin dhe dhurojnë elektronet në mënyrë të barabartë.
Lidhjet e lidhjeve hidrogjen
Hidrogjeni karakterizohet nga gjithmonë një ngarkesë pozitive, dhe për të kryer këtë lidhje është e nevojshme që ajo të tërhiqet nga një atom me një ngarkesë elektronegative, e cila falë këtij procesi është e mundur të vëzhgohet se si formohet një bashkim midis dy. ai që ishte emëruar si një urë hidrogjeni që është nga buron emri i lidhjes.
Lidhje me Van der Waals
Në këtë lloj lidhje, mund të gjendet lidhja midis dy dipoleve të përhershëm, si dhe midis dy dipolave të induktuar, ose mund të ekzistojë mundësia që të gjenden lidhje midis një dipoli të përhershëm dhe një të induktuar. Mënyra e vetme që kjo të ndodhë është midis dy molekulave simetrike, të cilat fillojnë të veprojnë kur ekziston një tërheqje ose zmbrapsje midis molekulave ose si parazgjedhje ndërveprimi midis joneve dhe molekulave.
Falë studimit të vazhdueshëm që vlen për të gjitha llojet e lidhjeve kimike ekzistuese është se ka qenë e mundur të kuptohet pak më shumë se si funksionon materia dhe si mund të shndërrohet në një produkt krejtësisht të ri ose të kthehet në formën e tij pasi të ndryshojë në një veprim të shkëmbimit të elektronit siç përshkruhet në shumicën e këtyre proceseve.
E gjithë kjo njohuri është arritur falë përparimit që ka pasur teknologjia, pasi që më parë spekulohej vetëm ekzistenca e atomeve dhe një shembull i kësaj është ekzistenca e modeleve atomike të mendimtarëve të mëdhenj filozofikë, megjithëse ato nuk ishin aq larg nga ajo që është e njohur sot, sot ka qenë e mundur të kuptohen më mirë proceset.