La materia está conformado por pequeñas partículas que son invisibles para el ojo humano, a las cuales se les denominó como átomos y moléculas que son los principales componentes de lo que hoy conocemos como la materia.
Las partículas antes mencionadas suelen entrar en un proceso de unión al cual se le conoce como enlaces químicos, y estos son estudiados por la química para poder comprender los miles de procesos biológicos que ocurren a diario en frente de nosotros pero que no pueden ser percibidos con facilidad. Por medio de ellos es que se han logrado comprender la mayoría de los sucesos que hacen el mundo como es.
¿Qué son los enlaces químicos?

Todas las cosas existentes en el mundo incluyendo los seres vivos, entre los cuales están los seres humanos están conformadas por la unión de algunos átomos y moléculas que deciden unirse mediante un proceso al cual se le conoce como un enlace químico. Es bien sabido que todos los organismos vivientes e incluso los inertes (objetos inanimados) están conformados por la materia, y ésta depende de los enlaces químicos para poder crearse.
Dependiendo de cómo se unen los átomos y las moléculas es que se puede determinar que tipo de enlace químico se está tratando, y entre los más comunes se pueden encontrar a los enlaces iónicos, los covalentes y los metálicos, aunque se han encontrado dos tipos de enlaces nuevos que no son muy conocidos cuando se habla del tema, que son los enlaces por puente de hidrógeno y los Van der Waals.
Los enlaces químicos se denominan como aquellas fuerzas que hacen que se mantengan unidos dos o más átomos por un tiempo determinado, y que permite la transmisión de electrones entre ellos.
El proceso de atracción que ocurre entre los dos átomos en algo un poco extraño pero que si se analiza con un poco de atención se podrá comprender con mucha facilidad. Lo principal que hay que saber es que los núcleos que poseen cargas positivas se alejan, pero a la vez se pueden ver atraídos gracias a los electrones con carga negativa que se encuentran en su superficie, que en varias ocasiones puede ser mayor que la fuerza que hace que se alejen los núcleos.
Cuando sucede el proceso de los enlaces químicos usualmente, por no decir todo el tiempo unos átomos pierden electrones mientras que otros los van ganando, pero al final del proceso se puede observar una estabilidad eléctrica entre toda la acción.
Los 5 tipos de enlaces químicos
A continuación se mostrarán los enlaces químicos y algunas de sus características para poder comprender como es su funcionamiento.

Enlaces metálicos
En éste tipo de enlaces se puede observar cómo se crea una nube que mantiene unido a todo el conjunto de átomos, la cual es formada por los electrones sueltos. Se puede observar en éste proceso cómo los átomos se transforman en electrones e iones, en lugar de suceder como sería normalmente quedando un átomo adyacente.
Los enlaces metálicos suelen formar redes consideradas cristalinas, las cuales poseen un alto índice de coordinación.
En las caras de éstas redes se pueden observar tres tipos diferentes de redes cristalinas, las cuales tienen diferentes puntos de coordinación que van cambiando dependiendo del lugar en el que se encuentren llegando a tener 12 puntos, 8 puntos y la última con 6 puntos, sin embargo se dice que el nivel de valencia de los átomos metálicos siempre es pequeño.
Enlaces iónicos
Cuando se está hablando de enlaces iónicos se quiere referir a la unión entre átomos que tienen poca energía electroestática con los que poseen una energía del mismo tipo mayor que las primeras, que usualmente son un elemento metálico y uno no metálico. Para que esto ocurra es necesario que uno de los átomos pueda perder electrones, y que el otro pueda ganarlos consecutivamente. Por lo tanto se puede describir éste enlace como un proceso en el que dos átomos poseen una atracción electroestática, en la que participan uno con mayor atracción y el otro con menor atracción.
Se demostró que a los elementos no metálicos les falta un electrón en su composición para poder tener su órbita completa y es por éste motivo que el mismo se convierte en receptor del proceso, al cual se le denomina como un anión.
Los elementos metálicos se conocen como los cationes debido a que poseen una carga positiva que es lo contrario a los aniones, y como poseen un electrón en lo último de su composición tienen la capacidad de unirse a otros átomos, en éste caso los no metálicos.
Guiándose por lo que se ha descrito se puede deducir que en éste tipo de enlace químico los átomos se atraen por una fuerza electroestática, y por ende el anión atrae al catión, y es allí cuando se puede observar cuando uno de los átomos cede mientras que el otro absorbe. Cuando éste compuesto se mantiene sólido se mantiene como se ha descrito y estable, pero al preciso momento que es puesto en un ambiente húmedo o en por defecto en algún líquido volverían a separarse manteniendo sus cargas eléctricas.
Enlaces covalentes
En los enlaces covalentes los átomos tienen la capacidad de atraerse y compartir los electrones o de absorberlos como en los casos antes mencionados, y se ha podido demostrar que cuando estos ocurren los iones son mucho más estables.
Aunque se puede decir que la mayoría de los enlaces tienen una capacidad de ser conductores de electricidad, pero en éste caso resulta que una gran parte no lo es. Toda la materia orgánica está conformada por enlaces covalentes, ya que como se mencionó anteriormente ésta es mucho más estable.
Estos enlaces tienen su propia división que varía dependiendo de si es una mezcla pura o no, los cuales se han denominado como enlaces polares y los no polares de los cuales se dará una breve explicación a continuación
Enlace covalente polar
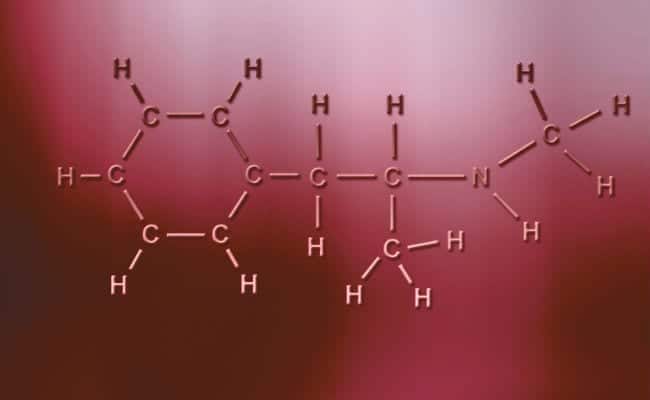
Los enlaces covalentes polares tienen como principal característica que son totalmente asimétricos, en el sentido que los átomos con carga positiva o negativa pueden tener dos electrones para compartir o dos espacios para absorber mientras que el otro solo tiene uno variando los casos. Estos suceden prácticamente al igual que los enlaces iónicos pero con la única diferencia de que para que los átomos se unan sucede un enlace covalente polar. Para que estos ocurran tienen que darse entre dos elementos no metálicos totalmente distintos,
Enlace covalente no polar
A diferencia del tipo de enlace químico descrito anteriormente en éste caso tienen que haber dos o más átomos de un no metal del mismo tipo. Éste es totalmente distinto al polar en todos los sentidos, y esto se puede demostrar al conocer que cuando dos átomos de un mismo elemento se comparten electrones al ser totalmente simétrico el proceso, se mantienen equilibrados y ambos reciben y donan electrones por igual.
Enlaces de puentes de hidrógeno
El hidrógeno se caracteriza por siempre tener una carga positiva, y para poder llevarse a cabo éste enlace es necesario que el mismo se vea atraído por un átomo con carga electronegativa, que gracias a ese proceso se puede observar cómo se forma una unión entre ambos a la que se denominó como un puente de hidrógeno que es de donde deriva el nombre del enlace.
Enlaces de Van der Waals
En éste tipo de enlaces se puede encontrar la unión entre dos dipolos permanentes, así como también entre dos dipolos inducidos o puede existir la posibilidad de que se encuentren uniones entre un dipolo permanente y uno inducido. La única manera de que esto suceda es entre dos moléculas simétricas, las cuales comienzan a actuar cuando existe una atracción o repulsión entre moléculas o por defecto la interacción entre unos iones y las moléculas.
Gracias al constante estudio que se le aplica a todos los tipos de enlaces químicos existentes es que se ha podido comprender un poco más el funcionamiento de la materia y cómo ésta puede transformarse en un producto totalmente nuevo o volver a su forma luego de cambiar en una acción de intercambio de electrones como se describe en la mayoría de estos procesos.
Todos estos conocimientos se han logrado conseguir gracias al avance que ha tenido la tecnología, ya que anteriormente solo se especulaba de la existencia de los átomos y un ejemplo de esto es la existencia de los modelos atómicos de grandes pensadores filosóficos, aunque ellos no estaban tan lejos de lo que se conoce hoy en día, en la actualidad se ha podido comprender mejor los procesos.