Ang bagay ay binubuo ng maliliit na mga particle na hindi nakikita ng mata ng tao, na kung tawagin ay mga atomo at molekula na pangunahing sangkap ng alam natin ngayon bilang bagay.
Karaniwan ang nabanggit na mga maliit na butil ipasok ang isang proseso ng bonding na kilala bilang bonding ng kemikal, at ang mga ito ay pinag-aaralan ng kimika upang maunawaan ang libu-libong mga proseso ng biological na nangyayari araw-araw sa harap natin ngunit hindi madali itong malasin. Ito ay sa pamamagitan ng mga ito na kanilang napag-unawaang maunawaan ang karamihan sa mga kaganapan na ginagawang tunay ang mundo.
Ano ang mga bono ng kemikal?

Ang lahat ng mga mayroon nang mga bagay sa mundo kabilang ang mga nabubuhay na buhay, bukod dito ay mga tao, ay binubuo ng pagsasama ng ilang mga atomo at mga molekula na nagpasya na sumali sa pamamagitan ng isang proseso na kilala bilang isang bono ng kemikal. Alam na alam na ang lahat ng mga nabubuhay na organismo at maging ang mga inert (walang buhay na mga bagay) ay binubuo ng bagay, at nakasalalay ito sa mga bono ng kemikal na makakalikha ng sarili nito.
Nakasalalay sa kung paano sumali ang mga atomo at molekula, posible na matukoy kung anong uri ng bond ng kemikal ang ginagamot, at kabilang sa mga pinakakaraniwan na matatagpuan ang mga ionic, covalent at metallic bond, bagaman may dalawang uri ng bono ang natagpuan. Bago mga bono na hindi gaanong kilala pagdating sa paksa, na kung saan ay mga hydrogen bridge bond at Van der Waals.
Ang mga bono ng kemikal ay tinatawag na mga puwersang gumawa ng dalawa o higit pang mga atom na magkakasama sa isang tiyak na oras, at pinapayagan ang paghahatid ng mga electron sa pagitan nila.
Ang proseso ng pagkahumaling na nangyayari sa pagitan ng dalawang mga atomo sa isang bagay na medyo kakaiba ngunit na kung ito ay pinag-aralan ng kaunting pansin madali itong maiintindihan. Ang pangunahing bagay na dapat malaman ay ang mga nuclei na may positibong singil ay lumilipat, ngunit sa parehong oras maaari silang maakit salamat sa mga electron na may negatibong singil na nasa kanilang ibabaw, na sa maraming mga okasyon ay maaaring mas malaki kaysa sa puwersa na ito sanhi upang lumayo ang nuclei.
Kapag ang proseso ng pagbubuklod ng kemikal ay nangyayari nang madalas, kung hindi sa lahat ng oras ang ilang mga atomo ay nawawalan ng mga electron habang ang iba ay nanalo, ngunit sa pagtatapos ng proseso ay maaaring mapagmasdan ang isang katatagan sa elektrisidad sa pagitan ng lahat ng mga aksyon.
Ang 5 uri ng mga bono ng kemikal
Ang mga bono ng kemikal at ilan sa kanilang mga katangian ay ipapakita sa ibaba upang maunawaan kung paano sila gumagana.

Mga link ng metal
Sa ganitong uri ng bono maaari mong makita kung paano nilikha ang isang ulap na humahawak sa buong hanay ng mga atomo, na nabuo ng mga maluwag na electron. Maaari itong obserbahan sa prosesong ito kung paano ang mga atomo ay binago sa mga electron at ions, sa halip na mangyari tulad ng dati, nag-iiwan ng katabing atom.
Ang mga metal bond ay karaniwang bumubuo ng mga network na itinuturing na mala-kristal, na may mataas na index ng koordinasyon.
Sa mga mukha ng mga network na ito maaari mong makita ang tatlong magkakaibang uri ng mga mala-kristal na network, na may magkakaibang mga puntos ng koordinasyon na nagbabago depende sa kung nasaan sila, na umaabot sa 12 puntos, 8 puntos at ang huli na may 6 na puntos, nang walang Gayunpaman, sinabi na ang antas ng valence ng mga metal atoms ay laging maliit.
Ionic bond
Kapag pinag-uusapan natin ang tungkol sa mga ionic bond, nais naming mag-refer sa unyon sa pagitan ng mga atomo na may maliit na lakas na electrostatic sa mga may lakas na parehong uri na mas malaki kaysa sa mga una, na kadalasang isang elemento ng metal at isang hindi metal na elemento . Upang maganap ito kinakailangan kinakailangan na ang isa sa mga atomo ay maaaring mawala ang mga electron, at ang iba pa ay maaaring makuha ang mga ito nang sunud-sunod. Samakatuwid, ang bono na ito ay maaaring inilarawan bilang isang proseso kung saan ang dalawang mga atomo ay may isang pagkahumaling sa electrostatic, kung saan ang isang nakikilahok na may higit na pagkahumaling at ang iba pa ay may mas kaunting akit.
Ipinakita na ang mga elemento na hindi metal ay walang electron sa kanilang komposisyon upang magkaroon ng kanilang kumpletong orbit at ito ang kadahilanang ito ay nagiging isang tatanggap ng proseso, na tinatawag na anion.
Ang mga elemento ng metal ay kilala bilang mga cation sapagkat mayroon silang positibong singil na kabaligtaran ng mga anion, at dahil mayroon silang isang electron sa huling bahagi ng kanilang komposisyon, mayroon silang kakayahang magbigkis sa iba pang mga atomo, sa kasong ito mga hindi metal.
Pinatnubayan ng inilarawan, mahihinuha na sa ganitong uri ng bond ng kemikal ang mga atomo ay naaakit ng isang electrostatic force, at samakatuwid ang anion ay umaakit sa cation, at naroroon ito kapag ito ay maaaring sundin kapag ang isa sa mga atomo ay magbubunga. habang ang iba ay sumisipsip. Kapag ang compound na ito ay mananatiling solid, mananatili ito tulad ng inilarawan at matatag, ngunit sa tumpak na sandali na inilalagay ito sa isang mahalumigmig na kapaligiran o bilang default sa ilang likido, maghihiwalay silang muli, pinapanatili ang kanilang singil sa kuryente.
Covalent bond
Sa mga covalent bond, ang mga atomo ay may kakayahang makaakit at magbahagi ng mga electron o sumipsip ng mga ito tulad ng sa mga kaso na nabanggit sa itaas, at ipinakita na kapag nangyari ito ang mga ions ay mas matatag.
Kahit na masasabing ang karamihan sa mga link ay may kapasidad na maging conductor ng kuryente, ngunit sa kasong ito lumalabas na ang isang malaking bahagi ay hindi. Ang lahat ng mga organikong bagay ay binubuo ng mga covalent bond, dahil tulad ng nabanggit sa itaas ay mas matatag ito.
Ang mga bono ay may kani-kanilang dibisyon na nag-iiba depende sa kung ito ay isang purong timpla o hindi, na tinawag na polar bond at mga nonpolar bond kung saan ibibigay ang isang maikling paliwanag sa ibaba.
Polar covalent bond
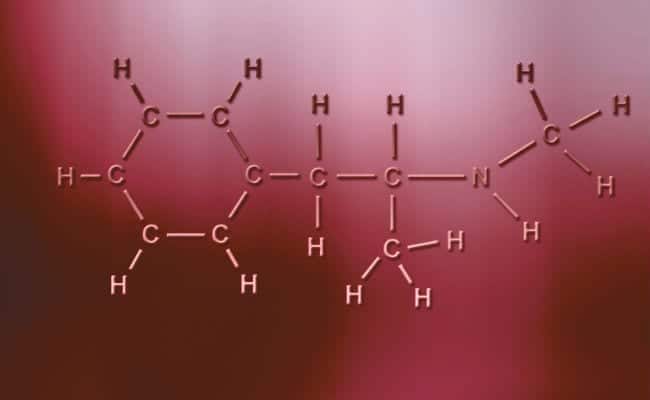
Ang pangunahing katangian ng mga polar covalent bond ay ang mga ito ay ganap na walang simetriko, sa diwa na ang mga atomo na may positibo o negatibong singil ay maaaring magkaroon ng dalawang electron na maibabahagi o dalawang puwang na naisisipsip habang ang isa ay mayroon lamang, iba-iba ang mga kaso. Ang mga ito ay nangyayari halos kapareho ng mga ionic bond ngunit may pagkakaiba lamang na upang magkaisa ang mga atomo, nangyayari ang isang polar covalent bond. Para sa mga ito upang mangyari kailangan nilang maganap sa pagitan ng dalawang ganap na magkakaibang mga di-metal na elemento,
Nonpolar covalent bond
Hindi tulad ng uri ng bond ng kemikal na inilarawan sa itaas, sa kasong ito dapat mayroong dalawa o higit pang mga atomo ng isang nonmetal ng parehong uri. Ito ay ganap na naiiba mula sa polar sa bawat paraan, at maaari itong maipakita sa pamamagitan ng pag-alam na kapag ang dalawang mga atomo ng parehong elemento ay nagbabahagi ng mga electron habang ang proseso ay ganap na simetriko, mananatili silang balansehin at kapwa tumatanggap at nag-aabuloy ng mga electron.
Mga bono ng hydrogen bond
Ang hydrogen ay nailalarawan sa pamamagitan ng laging pagkakaroon ng isang positibong singil, at upang maisakatuparan ang bono na ito kinakailangan na maakit ito ng isang atom na may isang electronegative charge, na salamat sa prosesong ito posible na obserbahan kung paano nabuo ang isang unyon sa pagitan ng dalawa sa isa na pinangalanan tulad ng isang tulay na hydrogen na mula sa kung saan nagmula ang pangalan ng bono.
Mga link sa Van der Waals
Sa ganitong uri ng mga link, matatagpuan ang unyon sa pagitan ng dalawang permanenteng dipole, pati na rin sa pagitan ng dalawang sapilitan na dipole, o maaaring may posibilidad na ang mga unyon ay matatagpuan sa pagitan ng isang permanenteng at isang sapilitan na dipole. Ang tanging paraan lamang upang maganap ito ay sa pagitan ng dalawang simetriko na mga molekula, na nagsisimulang kumilos kapag mayroong isang pagkahumaling o pagtulak sa pagitan ng mga molekula o bilang default ang pakikipag-ugnayan sa pagitan ng mga ions at Molekyul.
Salamat sa patuloy na pag-aaral na nalalapat sa lahat ng uri ng mga umiiral na mga bono ng kemikal posible na maunawaan nang kaunti pa kung paano gumana ang bagay at kung paano ito mababago sa isang ganap na bagong produkto o bumalik sa hugis nito matapos baguhin ang isang pagkilos na palitan ng electron tulad ng inilarawan sa karamihan ng mga prosesong ito.
Ang lahat ng kaalamang ito ay nakamit salamat sa pagsulong ng teknolohiya, dahil dati ay naisip lamang ito tungkol sa pagkakaroon ng mga atomo at isang halimbawa nito ay ang pagkakaroon ng mga modelo ng atomiko ng mga dakilang pilosopo na nag-iisip, kahit na hindi sila ganon kalayo mula sa kung ano ang kilala ngayon, ngayon posible na mas maintindihan ang mga proseso.