Şizofreni kalıtsal olabilir mi?
Şizofreni, dünya nüfusunun önemli bir bölümünü etkileyen zihinsel bir hastalıktır. Yıllardır şizofreni...

Şizofreni, dünya nüfusunun önemli bir bölümünü etkileyen zihinsel bir hastalıktır. Yıllardır şizofreni...

Depresif gerçekçilik, aşırı iyimserliğe tepki olarak ortaya çıkan sanatsal ve edebi bir akımdır...

Belirli bir fiziksel ve zihinsel refahın tadını çıkarmak söz konusu olduğunda, en iyi şekilde uyumak çok önemlidir. Olmadan…

Kortizol halk arasında stres hormonu olarak bilinir ve temel bir rol oynayacaktır.

Agorafobi, kişinin kendisini belirli durumlarda bulma korkusuyla karakterize, kaygı ile ilişkili bir hastalıktır.
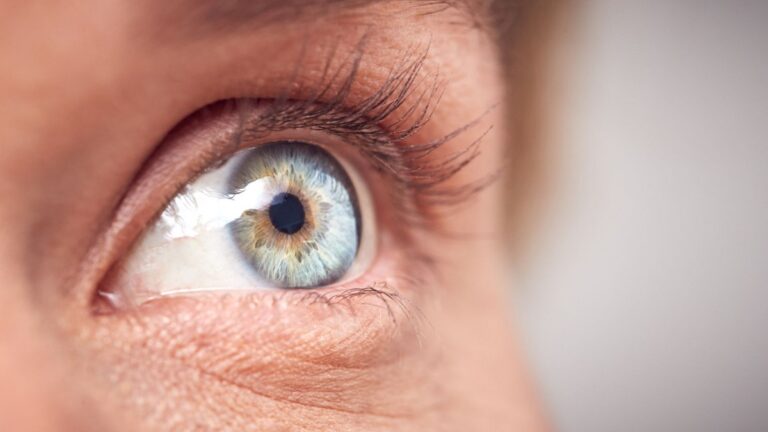
Bálint Sendromu, görsel algıyı etkileyen nadir bir nörolojik hastalıktır ve…

Dayanışma, sosyal adalet gibi kavramlar ekonomi ve finans dünyasına yabancı geliyor. EthicHub geliyor…

Şiddet ve istismar günümüz toplumunda ne yazık ki sürekli var olan bir şey...

Gözlerinizi kapatarak ve geçen yazın plaj tatilini hayal ederek başlayın. Yetenekli olman normal...

Psikotik kırılmalar çok karmaşık bir zihinsel olguyu temsil eder ve hem bu durumdan muzdarip olan kişi için hem de...

Bağlanma kavramı, insanlar arasında, genellikle de ebeveynler arasında oluşan duygusal bağı ifade eder...