تتكون المادة من جسيمات صغيرة غير مرئية للعين البشرية ، والتي تسمى الذرات والجزيئات التي تشكل المكونات الرئيسية لما نعرفه اليوم كمادة.
عادة ما تكون الجسيمات المذكورة أعلاه تدخل في عملية الترابط المعروفة باسم الترابط الكيميائي، ويتم دراستها بواسطة الكيمياء لفهم آلاف العمليات البيولوجية التي تحدث يوميًا أمامنا ولكن لا يمكن إدراك ذلك بسهولة. من خلالهم تمكنوا من فهم معظم الأحداث التي تجعل العالم كما هو.
ما هي الروابط الكيميائية؟

جميع الأشياء الموجودة في العالم بما في ذلك الكائنات الحية ، ومن بينها البشر ، تتكون من اتحاد بعض الذرات والجزيئات التي تقرر الانضمام من خلال عملية تعرف باسم الرابطة الكيميائية. من المعروف أن جميع الكائنات الحية وحتى الخاملة (الجماد) تتكون من مادة ، وهذا يعتمد على الروابط الكيميائية لتكون قادرة على تكوين نفسها.
اعتمادًا على كيفية ارتباط الذرات والجزيئات ، من الممكن تحديد نوع الرابطة الكيميائية التي يتم معالجتها ، ومن بين أكثرها شيوعًا يمكن العثور على الروابط الأيونية والتساهمية والمعدنية ، على الرغم من العثور على نوعين من الروابط الجديدة. الروابط غير المعروفة جيدًا عندما يتعلق الأمر بالموضوع ، وهي روابط جسر الهيدروجين و Van der Waals.
تسمى الروابط الكيميائية تلك القوى التي تجعل ذرتين أو أكثر تبقى معًا لفترة زمنية معينة ، والتي تسمح بنقل الإلكترونات بينهما.
عملية التجاذب التي تحدث بين الذرتين في شيء غريب بعض الشيء ولكن إذا تم تحليلها بقليل من الاهتمام فيمكن فهمها بسهولة بالغة. الشيء الرئيسي الذي يجب معرفته هو أن النوى التي لها شحنة موجبة تتحرك بعيدًا ، ولكن في نفس الوقت يمكن جذبها بفضل الإلكترونات ذات الشحنة السالبة الموجودة على سطحها ، والتي يمكن أن تكون في عدة مناسبات أكبر من القوة التي يتسبب في ابتعاد النوى.
عندما تحدث عملية الترابط الكيميائي عادةً ، إن لم يكن طوال الوقت تفقد بعض الذرات إلكتروناتها بينما يفوز الآخرون، ولكن في نهاية العملية يمكن ملاحظة استقرار كهربائي بين كل الإجراءات.
5 أنواع من الروابط الكيميائية
سيتم عرض الروابط الكيميائية وبعض خصائصها أدناه لفهم كيفية عملها.

روابط معدنية
في هذا النوع من الروابط ، يمكنك أن ترى كيف يتم إنشاء سحابة تحافظ على مجموعة الذرات بأكملها معًا ، والتي تتكون من الإلكترونات السائبة. يمكن ملاحظة في هذه العملية كيف تتحول الذرات إلى إلكترونات وأيونات ، بدلاً من أن يحدث كما هو معتاد ، تاركًا ذرة مجاورة.
عادة ما تشكل الروابط المعدنية شبكات تعتبر بلورية ، والتي لها مؤشر تنسيق عالٍ.
يمكنك أن ترى على وجوه هذه الشبكات ثلاثة أنواع مختلفة من الشبكات البلورية ، والتي لها نقاط تنسيق مختلفة تتغير حسب مكانها ، لتصل إلى 12 نقطة و 8 نقاط والأخيرة بـ 6 نقاط ، بدون مع ذلك يقال إن يكون مستوى التكافؤ لذرات المعدن دائمًا صغيرًا.
الرابطة الأيونية
عندما نتحدث عن الروابط الأيونية ، نريد أن نشير إلى الاتحاد بين الذرات التي لديها القليل من الطاقة الكهروستاتيكية مع تلك التي لديها طاقة من نفس النوع أكبر من الأولى ، والتي عادة ما تكون عنصرًا معدنيًا وعنصرًا غير معدني . ولكي يحدث هذا ، من الضروري أن تفقد إحدى الذرات إلكتروناتها ، وأن تكتسب الأخرى إلكتروناتها على التوالي. لذلك ، يمكن وصف هذه الرابطة بأنها عملية تمتلك فيها ذرتان جاذبية إلكتروستاتيكية ، تشارك فيها إحداهما بجاذبية أكبر والأخرى بجاذبية أقل.
تبين أن العناصر غير المعدنية تفتقر إلى الإلكترون في تكوينها لتكون قادرة على الحصول على مدارها الكامل ولهذا السبب تصبح مستقبلاً للعملية ، والتي تسمى الأنيون.
تُعرف العناصر المعدنية بالكاتيونات لأنها تحتوي على شحنة موجبة معاكسة للأنيونات ، ولأنها تحتوي على إلكترون في آخر تكوين لها ، فإنها تتمتع بالقدرة على الارتباط بذرات أخرى ، في هذه الحالة الذرات غير المعدنية.
استرشادًا بما تم وصفه ، يمكن استنتاج أنه في هذا النوع من الروابط الكيميائية ، تنجذب الذرات بقوة إلكتروستاتيكية ، وبالتالي يجذب الأنيون الكاتيون ، ويكون موجودًا عندما يمكن ملاحظته عندما تنتج إحدى الذرات بينما يمتص الآخر. عندما يظل هذا المركب صلبًا ، فإنه يظل كما هو موصوف ومستقرًا ، ولكن في اللحظة المحددة يتم وضعه في بيئة رطبة أو افتراضيًا في بعض السوائل ، سينفصلان مرة أخرى ، ويحافظان على شحناتهما الكهربائية.
روابط تساهمية
في الروابط التساهمية ، تمتلك الذرات القدرة على جذب الإلكترونات ومشاركتها أو امتصاصها كما في الحالات المذكورة أعلاه ، وقد ثبت أنه عندما تحدث هذه الأيونات تكون أكثر استقرارًا.
على الرغم من أنه يمكن القول أن معظم الوصلات لديها القدرة على أن تكون موصلات للكهرباء ، ولكن في هذه الحالة اتضح أن جزءًا كبيرًا ليس كذلك. تتكون جميع المواد العضوية من روابط تساهمية ، لأنها كما ذكرنا سابقًا أكثر استقرارًا.
هذه الروابط لها تقسيمها الخاص الذي يختلف اعتمادًا على ما إذا كان مزيجًا نقيًا أم لا ، والذي تم تسميته بالروابط القطبية والروابط غير القطبية والتي سيتم تقديم شرح موجز لها أدناه.
الرابطة التساهمية القطبية
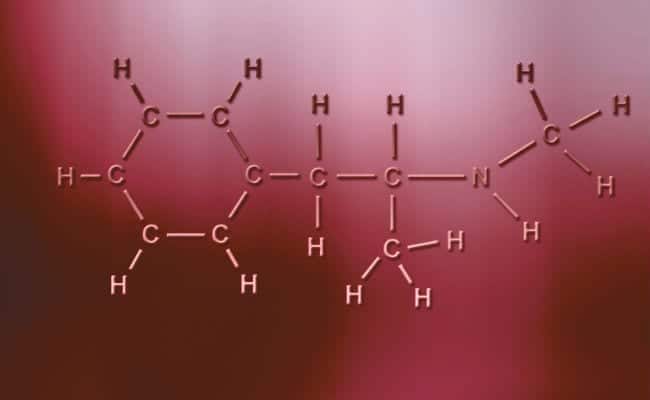
السمة الرئيسية للروابط التساهمية القطبية هي أنها غير متماثلة تمامًا ، بمعنى أن الذرات ذات الشحنة الموجبة أو السالبة يمكن أن يكون لها إلكترونان للمشاركة أو مسافتان لامتصاصهما بينما الآخر يحتوي على واحد فقط ، مع تغيير الحالات. يحدث هذا عمليًا مثل الروابط الأيونية ولكن مع الاختلاف الوحيد الذي يحدث عندما تتحد الذرات ، تحدث الرابطة التساهمية القطبية. لكي تحدث هذه يجب أن تحدث بين عنصرين غير معدنيين مختلفين تمامًا ،
الرابطة التساهمية اللاقطبية
على عكس نوع الرابطة الكيميائية الموصوفة أعلاه ، في هذه الحالة يجب أن يكون هناك ذرتان أو أكثر من اللافلزية من نفس النوع. هذا يختلف تمامًا عن القطبية من جميع النواحي ، ويمكن إثبات ذلك من خلال معرفة أنه عندما تشترك ذرتان من نفس العنصر في الإلكترونات لأن العملية متماثلة تمامًا ، فإنها تظل متوازنة ويستقبل كلاهما الإلكترونات ويتبرع بها بالتساوي.
روابط روابط الهيدروجين
يتميز الهيدروجين دائمًا بوجود شحنة موجبة ، ومن أجل تنفيذ هذه الرابطة من الضروري أن تنجذب بواسطة ذرة ذات شحنة كهربية ، والتي بفضل هذه العملية يمكن ملاحظة كيفية تكوين اتحاد بين اثنان في واحد كان مقومًا مثل جسر الهيدروجين الذي اشتق منه اسم الرابطة.
روابط لـ Van der Waals
في هذا النوع من الروابط ، يمكن العثور على الاتحاد بين ثنائيين أقطاب دائمين ، وكذلك بين ثنائيات أقطاب مستحثة ، أو قد يكون هناك احتمال أن يتم العثور على اتحادات بين ثنائي القطب الدائم والمستحث. الطريقة الوحيدة لحدوث ذلك هي بين جزيئين متماثلين ، يبدأان في العمل عندما يكون هناك تجاذب أو تنافر بين الجزيئات أو افتراضيًا التفاعل بين الأيونات والجزيئات.
بفضل الدراسة المستمرة لذلك ينطبق على جميع أنواع الروابط الكيميائية الموجودة هو أنه كان من الممكن فهم كيفية عمل المادة وكيف يمكن تحويلها إلى منتج جديد تمامًا أو العودة إلى شكلها بعد التغيير في إجراء تبادل الإلكترون كما هو موضح في معظم هذه العمليات.
كل هذه المعرفة قد تحققت بفضل تقدم التكنولوجيا ، حيث كانت في السابق تكهنات فقط حول وجود الذرات ومثال على ذلك هو وجود النماذج الذرية للمفكرين الفلسفيين العظماء ، على الرغم من أنهم لم يكونوا بعيدين عما هو موجود. معروف اليوم ، أصبح من الممكن اليوم فهم العمليات بشكل أفضل.