Η ύλη αποτελείται από μικρά σωματίδια που δεν είναι ορατά στο ανθρώπινο μάτι, τα οποία ονομάστηκαν άτομα και μόρια που αποτελούν τα κύρια συστατικά αυτού που γνωρίζουμε σήμερα ως ύλη.
Τα προαναφερθέντα σωματίδια είναι συνήθως εισαγάγετε μια διαδικασία συγκόλλησης γνωστή ως χημική σύνδεση, και αυτές μελετώνται από τη χημεία για να κατανοήσουμε τις χιλιάδες βιολογικές διεργασίες που συμβαίνουν καθημερινά μπροστά μας, αλλά δεν μπορούν να γίνουν αντιληπτές εύκολα. Είναι μέσω αυτών που κατάφεραν να καταλάβουν τα περισσότερα από τα γεγονότα που κάνουν τον κόσμο όπως είναι.
Τι είναι οι χημικοί δεσμοί;

Όλα τα υπάρχοντα πράγματα στον κόσμο, συμπεριλαμβανομένων των ζωντανών όντων, μεταξύ των οποίων είναι ανθρώπινα όντα, αποτελούνται από την ένωση ορισμένων ατόμων και μορίων που αποφασίζουν να ενωθούν μέσω μιας διαδικασίας γνωστής ως χημικός δεσμός. Είναι γνωστό ότι όλοι οι ζωντανοί οργανισμοί, ακόμη και τα αδρανή (άψυχα αντικείμενα) αποτελούνται από ύλη, και αυτό εξαρτάται από τους χημικούς δεσμούς για να μπορέσουν να δημιουργηθούν.
Ανάλογα με τον τρόπο σύνδεσης των ατόμων και των μορίων, είναι δυνατόν να προσδιοριστεί ο τύπος χημικού δεσμού που αντιμετωπίζεται και μεταξύ των πιο κοινών μπορεί να βρεθούν ιοντικοί, ομοιοπολικοί και μεταλλικοί δεσμοί, αν και έχουν βρεθεί δύο τύποι δεσμών. δεσμοί που δεν είναι πολύ γνωστοί όταν μιλάμε για το θέμα, που είναι οι δεσμοί γέφυρας υδρογόνου και οι Van der Waals.
Οι χημικοί δεσμοί ονομάζονται εκείνες οι δυνάμεις που κάνουν δύο ή περισσότερα άτομα να παραμείνουν μαζί για ένα ορισμένο χρονικό διάστημα και που επιτρέπουν τη μετάδοση ηλεκτρονίων μεταξύ τους.
Η διαδικασία έλξης που συμβαίνει μεταξύ των δύο ατόμων μετατρέπεται σε κάτι λίγο περίεργο, αλλά εάν αναλυθεί με λίγη προσοχή, μπορεί να γίνει κατανοητό πολύ εύκολα. Το κύριο πράγμα που πρέπει να γνωρίζετε είναι ότι οι πυρήνες που έχουν θετικά φορτία απομακρύνονται, αλλά ταυτόχρονα μπορούν να προσελκύονται χάρη στα αρνητικά φορτισμένα ηλεκτρόνια που βρίσκονται στην επιφάνειά τους, τα οποία σε πολλές περιπτώσεις μπορεί να είναι μεγαλύτερα από τη δύναμη που προκαλεί οι πυρήνες να απομακρυνθούν.
Όταν η διαδικασία χημικής συγκόλλησης συμβαίνει συνήθως, αν όχι όλη την ώρα μερικά άτομα χάνουν ηλεκτρόνια ενώ άλλοι κερδίζουν, αλλά στο τέλος της διαδικασίας μπορεί να παρατηρηθεί ηλεκτρική σταθερότητα μεταξύ όλων των ενεργειών.
Οι 5 τύποι χημικών δεσμών
Οι χημικοί δεσμοί και μερικά από τα χαρακτηριστικά τους θα παρουσιαστούν παρακάτω για να κατανοήσουμε πώς λειτουργούν.

Μεταλλικοί σύνδεσμοι
Σε αυτόν τον τύπο δεσμού μπορείτε να δείτε πώς δημιουργείται ένα σύννεφο που συγκρατεί ολόκληρο το σύνολο ατόμων, το οποίο σχηματίζεται από τα χαλαρά ηλεκτρόνια. Μπορεί να παρατηρηθεί σε αυτή τη διαδικασία πώς τα άτομα μετατρέπονται σε ηλεκτρόνια και ιόντα, αντί να συμβαίνουν όπως θα ήταν κανονικά, αφήνοντας ένα γειτονικό άτομο.
Οι μεταλλικοί δεσμοί συνήθως σχηματίζουν δίκτυα που θεωρούνται κρυσταλλικά, τα οποία έχουν υψηλό δείκτη συντονισμού.
Στις όψεις αυτών των δικτύων μπορείτε να δείτε τρεις διαφορετικούς τύπους κρυσταλλικών δικτύων, τα οποία έχουν διαφορετικά σημεία συντονισμού που αλλάζουν ανάλογα με το πού βρίσκονται, φτάνοντας 12 σημεία, 8 σημεία και το τελευταίο με 6 σημεία, χωρίς Ωστόσο, λέγεται ότι το Το επίπεδο σθένους των μεταλλικών ατόμων είναι πάντα μικρό.
Ιωνικοί δεσμοί
Όταν μιλάμε για ιοντικούς δεσμούς, θέλουμε να αναφερθούμε στην ένωση ατόμων που έχουν μικρή ηλεκτροστατική ενέργεια με εκείνα που έχουν ενέργεια του ίδιου τύπου μεγαλύτερη από τα πρώτα, τα οποία είναι συνήθως ένα μεταλλικό στοιχείο και ένα μη μεταλλικό στοιχείο . Για να συμβεί αυτό είναι απαραίτητο ένα από τα άτομα να χάσει ηλεκτρόνια και το άλλο να τα αποκτήσει διαδοχικά. Επομένως, αυτός ο δεσμός μπορεί να περιγραφεί ως μια διαδικασία στην οποία δύο άτομα έχουν ηλεκτροστατική έλξη, στην οποία το ένα συμμετέχει με μεγαλύτερη έλξη και το άλλο με λιγότερη έλξη.
Αποδείχθηκε ότι τα μη μεταλλικά στοιχεία δεν διαθέτουν ηλεκτρόνιο στη σύνθεσή τους για να έχουν την πλήρη τροχιά τους και για αυτόν τον λόγο καθίσταται δέκτης της διαδικασίας, που ονομάζεται ανιόν.
Τα μεταλλικά στοιχεία είναι γνωστά ως κατιόντα επειδή έχουν θετικό φορτίο που είναι το αντίθετο των ανιόντων, και δεδομένου ότι έχουν ένα ηλεκτρόνιο στο τελευταίο της σύνθεσής τους, έχουν την ικανότητα να συνδέονται με άλλα άτομα, στην περίπτωση αυτή μη μεταλλικά.
Καθοδηγούμενος από αυτό που έχει περιγραφεί, μπορεί να συναχθεί ότι σε αυτόν τον τύπο χημικού δεσμού τα άτομα έλκονται από μια ηλεκτροστατική δύναμη, και ως εκ τούτου το ανιόν προσελκύει το κατιόν, και αυτό είναι όταν μπορεί να παρατηρηθεί όταν ένα από τα άτομα αποδίδει ενώ το άλλο απορροφά. Όταν αυτή η ένωση παραμένει στερεή, παραμένει όπως περιγράφεται και είναι σταθερή, αλλά την ακριβή στιγμή τοποθετείται σε υγρό περιβάλλον ή από προεπιλογή σε κάποιο υγρό, θα διαχωρίσουν ξανά, διατηρώντας τα ηλεκτρικά τους φορτία.
Ομοιοπολικούς δεσμούς
Σε ομοιοπολικούς δεσμούς, τα άτομα έχουν την ικανότητα να προσελκύουν και να μοιράζονται ηλεκτρόνια ή να τα απορροφούν όπως στις παραπάνω περιπτώσεις και έχει αποδειχθεί ότι όταν συμβαίνουν αυτά τα ιόντα είναι πολύ πιο σταθερά.
Αν και μπορεί να ειπωθεί ότι οι περισσότεροι από τους συνδέσμους έχουν ικανότητα να είναι αγωγοί ηλεκτρικής ενέργειας, αλλά σε αυτήν την περίπτωση αποδεικνύεται ότι ένα μεγάλο μέρος δεν είναι. Όλη η οργανική ύλη αποτελείται από ομοιοπολικούς δεσμούς, καθώς όπως αναφέρθηκε παραπάνω είναι πολύ πιο σταθερή.
Αυτοί οι δεσμοί έχουν τη δική τους διαίρεση που ποικίλλει ανάλογα με το αν είναι ένα καθαρό μείγμα ή όχι, που έχουν ονομαστεί πολικοί δεσμοί και οι μη πολικοί δεσμοί για τους οποίους θα δοθεί μια σύντομη εξήγηση παρακάτω.
Πολικός ομοιοπολικός δεσμός
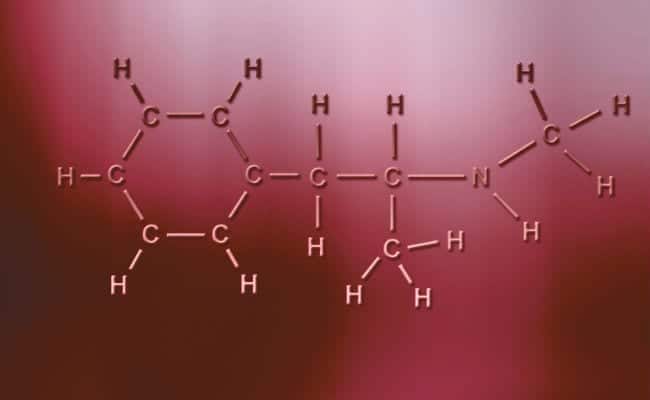
Το κύριο χαρακτηριστικό των πολικών ομοιοπολικών δεσμών είναι ότι είναι εντελώς ασύμμετροι, με την έννοια ότι τα άτομα με θετικό ή αρνητικό φορτίο μπορούν να έχουν δύο ηλεκτρόνια να μοιραστούν ή δύο κενά να απορροφήσουν, ενώ το άλλο έχει μόνο ένα, που ποικίλει τις περιπτώσεις. Αυτά συμβαίνουν πρακτικά τα ίδια με τους ιοντικούς δεσμούς, αλλά με τη μόνη διαφορά ότι για την ένωση των ατόμων, εμφανίζεται ένας πολικός ομοιοπολικός δεσμός. Για να συμβούν αυτά πρέπει να συμβούν μεταξύ δύο εντελώς διαφορετικών μη μεταλλικών στοιχείων,
Μη πολικός ομοιοπολικός δεσμός
Σε αντίθεση με τον τύπο του χημικού δεσμού που περιγράφηκε παραπάνω, στην περίπτωση αυτή πρέπει να υπάρχουν δύο ή περισσότερα άτομα ενός μη μετάλλου του ίδιου τύπου. Αυτό είναι τελείως διαφορετικό από τον πολικό με κάθε τρόπο, και αυτό μπορεί να αποδειχθεί γνωρίζοντας ότι όταν δύο άτομα του ίδιου στοιχείου μοιράζονται ηλεκτρόνια καθώς η διαδικασία είναι εντελώς συμμετρική, παραμένουν ισορροπημένα και αμφότερα λαμβάνουν και δωρίζουν ηλεκτρόνια εξίσου.
Δεσμοί υδρογόνου
Το υδρογόνο χαρακτηρίζεται από το ότι έχει πάντα ένα θετικό φορτίο και για να επιτευχθεί αυτός ο δεσμός είναι απαραίτητο να προσελκύεται από ένα άτομο με ένα ηλεκτροαρνητικό φορτίο, το οποίο χάρη σε αυτήν τη διαδικασία είναι δυνατόν να παρατηρηθεί πώς σχηματίζεται μια ένωση μεταξύ του δύο σε εκείνη που είχε ονομασία σαν γέφυρα υδρογόνου που προέρχεται από το όνομα του δεσμού.
Σύνδεσμοι προς Van der Waals
Σε αυτόν τον τύπο συνδέσμων, μπορεί να βρεθεί η ένωση μεταξύ δύο μόνιμων διπόλων, καθώς και μεταξύ δύο επαγόμενων διπόλων, ή μπορεί να υπάρχει η πιθανότητα να βρεθούν ενώσεις μεταξύ μόνιμου και επαγόμενου διπόλου. Ο μόνος τρόπος για να συμβεί αυτό είναι μεταξύ δύο συμμετρικών μορίων, τα οποία αρχίζουν να δρουν όταν υπάρχει έλξη ή απώθηση μεταξύ μορίων ή εξ ορισμού η αλληλεπίδραση μεταξύ ιόντων και μορίων.
Χάρη στη συνεχή μελέτη ότι ισχύει για όλους τους τύπους υφιστάμενων χημικών δεσμών είναι ότι ήταν δυνατό να κατανοήσουμε λίγο περισσότερο πώς λειτουργεί η ύλη και πώς μπορεί να μετατραπεί σε ένα εντελώς νέο προϊόν ή να επιστρέψει στο σχήμα του μετά την αλλαγή σε μια ενέργεια ανταλλαγής ηλεκτρονίων όπως περιγράφεται στις περισσότερες από αυτές τις διαδικασίες.
Όλη αυτή η γνώση έχει επιτευχθεί χάρη στην πρόοδο της τεχνολογίας, δεδομένου ότι στο παρελθόν ήταν μόνο εικασίες για την ύπαρξη ατόμων και ένα παράδειγμα αυτού είναι η ύπαρξη των ατομικών μοντέλων μεγάλων φιλοσοφικών στοχαστών, αν και δεν ήταν τόσο μακριά από αυτό που είναι γνωστό σήμερα, σήμερα ήταν δυνατό να κατανοήσουμε καλύτερα τις διαδικασίες.