Materie bestaat uit kleine deeltjes die onzichtbaar zijn voor het menselijk oog, die atomen en moleculen worden genoemd en die de belangrijkste componenten zijn van wat we tegenwoordig kennen als materie.
De bovengenoemde deeltjes zijn meestal voer een hechtingsproces in dat bekend staat als chemische binding, en deze worden chemisch bestudeerd om de duizenden biologische processen te begrijpen die dagelijks voor ons plaatsvinden, maar die niet gemakkelijk kunnen worden waargenomen. Door hen hebben ze de meeste gebeurtenissen kunnen begrijpen die de wereld maken zoals ze is.
Wat zijn chemische bindingen?

Alle bestaande dingen in de wereld, inclusief levende wezens, waaronder mensen, bestaan uit de vereniging van enkele atomen en moleculen die besluiten zich aan te sluiten via een proces dat bekend staat als een chemische binding. Het is bekend dat alle levende organismen en zelfs inerte (levenloze objecten) uit materie bestaan, en dit hangt af van chemische bindingen om zichzelf te kunnen creëren.
Afhankelijk van hoe de atomen en moleculen zijn samengevoegd, is het mogelijk om te bepalen welk type chemische binding wordt behandeld, en een van de meest voorkomende zijn ionische, covalente en metallische bindingen, hoewel twee soorten nieuwe bindingen die niet erg zijn welbekend als het om het onderwerp gaat, namelijk waterstofbruggen en Van der Waals.
Chemische bindingen worden die krachten genoemd die ervoor zorgen dat twee of meer atomen een bepaalde tijd bij elkaar blijven en die de transmissie van elektronen tussen hen mogelijk maken.
Het proces van aantrekking dat plaatsvindt tussen de twee atomen in iets vreemds, maar dat als het met een beetje aandacht wordt geanalyseerd, heel gemakkelijk kan worden begrepen. Het belangrijkste om te weten is dat de kernen met positieve ladingen weggaan, maar tegelijkertijd kunnen worden aangetrokken dankzij de negatief geladen elektronen op hun oppervlak, die bij verschillende gelegenheden groter kunnen zijn dan de kracht die het veroorzaakt. de kernen om weg te gaan.
Wanneer het chemische hechtingsproces meestal plaatsvindt, zo niet altijd sommige atomen verliezen elektronen terwijl anderen winnen, maar aan het einde van het proces kan een elektrische stabiliteit worden waargenomen tussen alle handelingen.
De 5 soorten chemische bindingen
De chemische bindingen en enkele van hun kenmerken worden hieronder weergegeven om te begrijpen hoe ze werken.

Metalen schakels
In dit type binding kun je zien hoe een wolk ontstaat die de hele set atomen bij elkaar houdt, die wordt gevormd door de losse elektronen. In dit proces kan worden waargenomen hoe de atomen worden omgezet in elektronen en ionen, in plaats van te gebeuren zoals het normaal zou zijn, waardoor een aangrenzend atoom overblijft.
Metaalverbindingen vormen gewoonlijk netwerken die als kristallijn worden beschouwd en die een hoge coördinatie-index hebben.
Op de gezichten van deze netwerken kun je drie verschillende soorten kristallijne netwerken zien, die verschillende coördinatiepunten hebben die veranderen afhankelijk van waar ze zijn, 12 punten bereiken, 8 punten en de laatste met 6 punten, zonder Er wordt echter gezegd dat de valentieniveau van metaalatomen is altijd klein.
Ionische bindingen
Als we het hebben over ionische bindingen, willen we verwijzen naar de vereniging tussen atomen die weinig elektrostatische energie hebben met atomen met een energie van hetzelfde type groter dan de eerste, die meestal een metallisch element en een niet-metallisch element zijn. . Om dit te laten gebeuren, is het nodig dat een van de atomen elektronen kan verliezen, en dat de andere ze achtereenvolgens kan winnen. Daarom kan deze binding worden omschreven als een proces waarbij twee atomen een elektrostatische aantrekkingskracht hebben, waarbij de ene met grotere aantrekkingskracht en de andere met minder aantrekkingskracht deelneemt.
Er werd aangetoond dat niet-metalen elementen een elektron in hun samenstelling missen om hun volledige baan te kunnen hebben en daarom wordt het een ontvanger van het proces, dat een anion wordt genoemd.
Metallische elementen staan bekend als kationen omdat ze een positieve lading hebben die het tegenovergestelde is van anionen, en omdat ze een elektron hebben in de laatste van hun samenstelling, kunnen ze zich binden aan andere atomen, in dit geval niet-metalen.
Geleid door wat is beschreven, kan worden afgeleid dat in dit type chemische binding de atomen worden aangetrokken door een elektrostatische kracht, en daarom trekt het anion het kation aan, en dat is wanneer het kan worden waargenomen wanneer een van de atomen meegeeft terwijl de andere absorbeert. Wanneer deze verbinding vast blijft, blijft het zoals beschreven en stabiel, maar op het moment dat het in een vochtige omgeving of standaard in een vloeistof wordt geplaatst, zouden ze weer scheiden en hun elektrische lading behouden.
Covalente bindingen
In covalente bindingen hebben atomen het vermogen elektronen aan te trekken en te delen of ze te absorberen zoals in de hierboven genoemde gevallen, en het is aangetoond dat wanneer deze zich voordoen, de ionen veel stabieler zijn.
Hoewel kan worden gezegd dat de meeste schakels het vermogen hebben om elektriciteit te geleiden, maar in dit geval blijkt dat een groot deel dat niet is. Alle organische stof bestaat uit covalente bindingen, omdat het, zoals hierboven vermeld, veel stabieler is.
Deze bindingen hebben hun eigen verdeling die varieert naargelang het een puur mengsel is of niet, die polaire bindingen en niet-polaire bindingen worden genoemd, waarvan hieronder een korte uitleg zal worden gegeven.
Polaire covalente binding
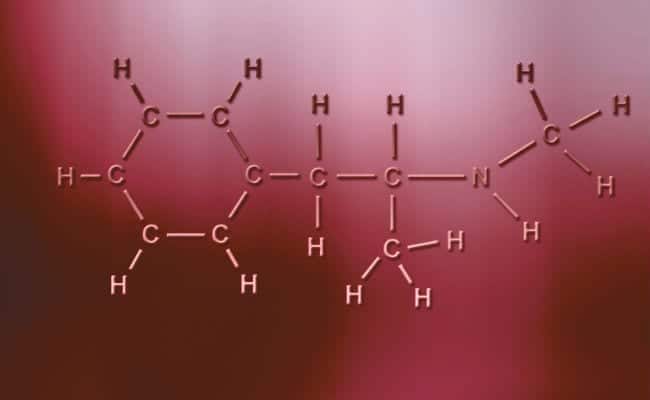
Het belangrijkste kenmerk van polaire covalente bindingen is dat ze totaal asymmetrisch zijn, in die zin dat atomen met een positieve of negatieve lading twee elektronen kunnen hebben om te delen of twee ruimtes om te absorberen, terwijl de andere er maar één heeft, waarbij de gevallen variëren. Deze gebeuren praktisch hetzelfde als ionische bindingen, maar met het enige verschil dat voor de atomen om zich te verenigen, er een polaire covalente binding optreedt. Om deze te laten plaatsvinden, moeten ze voorkomen tussen twee totaal verschillende niet-metalen elementen,
Niet-polaire covalente binding
In tegenstelling tot het hierboven beschreven type chemische binding, moeten er in dit geval twee of meer atomen zijn van een niet-metaal van hetzelfde type. Dit is in alle opzichten totaal verschillend van polair, en dit kan worden aangetoond door te weten dat wanneer twee atomen van hetzelfde element elektronen delen omdat het proces volledig symmetrisch is, ze in evenwicht blijven en zowel elektronen ontvangen als doneren.
Waterstofbindingen
Waterstof wordt gekenmerkt doordat het altijd een positieve lading heeft, en om deze binding tot stand te brengen is het noodzakelijk dat het wordt aangetrokken door een atoom met een elektronegatieve lading, waardoor het dankzij dit proces mogelijk is om te observeren hoe een unie wordt gevormd tussen de twee bij degene die werd aangeduid als een waterstofbrug, waar de naam van de binding vandaan komt.
Links naar Van der Waals
In dit type verbindingen kan de vereniging worden gevonden tussen twee permanente dipolen, evenals tussen twee geïnduceerde dipolen, of er kan de mogelijkheid zijn dat er unies worden gevonden tussen een permanente en een geïnduceerde dipool. De enige manier waarop dit kan gebeuren, is tussen twee symmetrische moleculen, die beginnen te werken wanneer er een aantrekking of afstoting is tussen moleculen of standaard de interactie tussen ionen en moleculen.
Dankzij de constante studie dat geldt voor alle soorten bestaande chemische bindingen is dat het mogelijk is geweest om een beetje meer te begrijpen hoe materie werkt en hoe het kan worden getransformeerd in een totaal nieuw product of terug kan keren naar zijn vorm na verandering in een elektronenuitwisselingsactie zoals beschreven in de meeste van deze processen.
Al deze kennis is bereikt dankzij de vooruitgang van de technologie, aangezien voorheen alleen werd gespeculeerd over het bestaan van atomen en een voorbeeld hiervan is het bestaan van de atomaire modellen van grote filosofische denkers, hoewel ze niet zo ver verwijderd waren van wat is tegenwoordig bekend, is het vandaag mogelijk geweest om de processen beter te begrijpen.