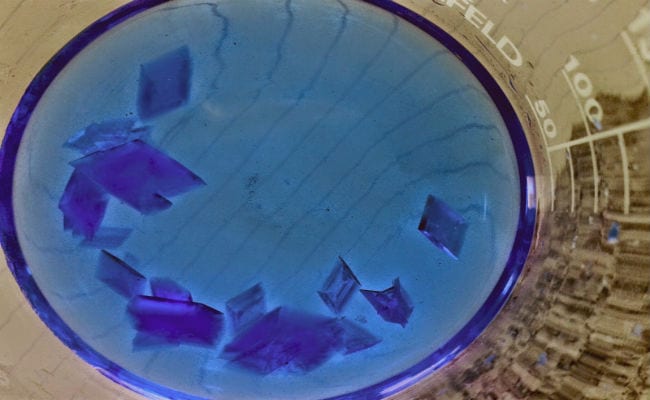
Cu siguranță ați auzit vreodată de cristale, este probabil ca în acest moment mintea dvs. să fi vizualizat un diamant imens, un ametist sau un topaz. Și cu siguranță, acest grup include și mulți dintre cei cunoscuți "Pietre pretioase", dar un cristal nu este o denumire care cuprinde în mod clar domeniul bijuteriilor.
Un cristal este produsul final al unui proces interesant cunoscut sub numele de cristalizare, care se caracterizează prin rezultatul unui solid omogen format din „fețe”, care sunt porțiuni situate în diferite planuri.
Caracteristicile solidului din cristalizare
Dimensiunea unui cristal este o caracteristică variabilă, într-o gamă largă de dimensiuni. Se pot găsi cristale „uriașe” care pot fi măsurate prin unitatea liniară „metru”, precum și noi găsește cristale asta trebuie să fie exprimat în termeni de „microni”, deoarece dimensiunea lor redusă le face comparabile cu microorganismele precum bacteriile, care sunt observabile doar prin microscop.
După cum sa menționat, procesele cristaline au ca rezultat produse de înaltă puritate, de aceea am stabilit, mai devreme în definiție, că cristalele sunt omogene: adică, compoziția produsului rămâne la o valoare constantă în orice punct al volumului solidului, ceea ce implică, de asemenea, că caracteristicile fizice și chimice rămân neschimbate pe toată durata piesei și, în cazul observării variațiilor datorate unei perturbări, schimbarea va avea loc în întreaga specie. Această calitate face ca cristalele să fie produse valoroase în diferite domenii, de la aprecierea calității materialului, până la utilizarea procesului de cristalizare ca tehnică de separare a substanțelor.
Produsele cristaline pot fi izolate și la nivel de laborator, prin reacții controlate în ansambluri care emulează procesele spontane care au loc în natură. Unul dintre principalele avantaje ale cristalelor obținute în procesele controlate este că acestea prezintă forme mai regulate, care se potrivesc perfect cu figurile poligonale de o mai mare precizie.
Într-un cristal, trebuie să distingem fețele care fac parte din obișnuința cristalină reală (caracteristicile morfologice) și, pe baza numărului acestora, putem lua în considerare formele fundamentale ale solidului. De obicei în un cristal este definit prin combinarea mai multor forme fundamentale, principalele fiind următoarele:
- Pedion: Sticlă formată dintr-o singură față plană, fără echivalente.
- Pinacoid: Este alcătuit din două fețe echivalente una cu cealaltă în raport cu o axă de simetrie.
- Sfenoid: Cele două fețe echivalente care alcătuiesc acest solid se află în jurul unei axe binare.
- Prisma: Este alcătuit din fețe omoloage care alcătuiesc o zonă. Fiind „zona unui cristal” definită ca un set de fețe paralele cu aceeași direcție, corespunzătoare unei margini a aceluiași.
Structura cristalelor dintr-un punct de vedere intern poate fi considerată a fi constituită dintr-un sistem mai mult sau mai puțin omogen, periodic și anizotrop al unui material dizolvat care dezvoltă o structură în diferite puncte ale spațiului. Printre caracteristicile cristalelor, faptul că fiecare punct au o repetare regulată în spațiul ocupat de material. În cristalografie se numește fenomenul care influențează această acțiune traducere.
Procesul de cristalizare
Pentru ca cristalizarea să aibă loc, trebuie să pornim de la o substanță care poate fi clasificată ca "Cristalin", iar acest lucru este definit deoarece particulele care îl alcătuiesc, indiferent dacă sunt de natură atomică, moleculară sau ionică, au proprietăți de omogenitate, periodicitate și simetrie.
Întregul proces este activat când la un moment dat în substanța cristalină, particulele încep să se reorganizeze, într-o etapă cunoscută sub numele de nucleată. Întregul proces implică, pe lângă variația evidentă a ordinii particulelor, un proces de schimbare a condițiilor termodinamice, care sunt orientate către compensarea perturbărilor generate de schimbarea energiei libere Gibbs, care este marcată de trei evenimente:
- Schimbarea energiei chimice.
- Crearea unei interfețe între zona de nucleație și restul fazei omogene.
- Variația de volum și formă pe care o implică acest proces declanșează tensiuni.
Următoarea fază are originea atunci când structura bazei de nucleație se stabilizează. Următorul pas este ceva logic și previzibil, odată ce vom avea structura de bază vom intra într-un proces de crecimiento, în care se observă o modificare a dimensiunilor nucleului. Încetul cu încetul, această creștere va avea ca rezultat formarea fețelor, până când cristalul capătă un obicei bine definit.
Mecanismul creșterii cristalelor
Teoria dezvoltată de Volmer explică modul în care are loc creșterea unui cristal, stabilind că, în jurul structurii de bază din nucleația substanței cristaline, un fel de strat de absorbție, care acționează ca o interfață și, în plus față de aceasta, promovează o migrație de particule în jurul său, care se deplasează paralel cu suprafața. Rezultatul acestui proces este definit ca o structură definită într-un plan bidimensional.
La rândul lor, Kossel și Straski au stabilit că este necesară lucrarea mecanică pentru a realiza fixarea unui ion pe suprafața acestui strat și că acesta depinde de poziția sa.
Dezvoltarea unui model care definește creșterea necesită prognoza zonelor de saturație unde se observă o rată mai mare de schimbare (zonele locale de suprasaturare). Acest lucru arată că creșterea cristalelor are loc în straturi.
Cristalizarea ca mecanism de separare
Deoarece un cristal este format cu o substanță omogenă, utilizarea acestuia ca metodă de separare selectivă a substanțelor s-a răspândit, printre mai multe metode, mai jos, vom explica în ce constau cei care au o utilizare mai răspândită:
- Adăugarea unui nou solvent: Dacă cunoaștem natura produselor pe care le manipulăm, putem aplica această metodă, care constă practic în adăugarea unui nou solvent care interacționează cu solventul în care este scufundat solutul pe care dorim să îl cristalizăm. Când noul solvent începe să interacționeze selectiv cu omologul său, solutul precipită, inițind procesul de cristalizare.
- Răcire la concentrații ridicate de solut: Când avem o soluție cu concentrație ridicată, care a fost făcută la temperaturi ridicate și o supunem unui proces de răcire, obținem o condiție de suprasaturare, în care se dizolvă o cantitate mai mare de solut decât poate accepta solventul, în acele noi condiții de temperatură. Dacă procesul de reducere a temperaturii se face într-un mod controlat, putem influența dimensiunea cristalului pe care urmează să îl obținem.
- Sublimare: Această tehnică poate fi aplicată numai în compușii cristalini care prezintă o presiune de vapori ridicată, astfel încât transformările dintr-o fază gazoasă în una solidă să nu necesite trecerea prin punctul de topire.