Материја се састоји од малих честица које су невидљиве за људско око, а називале су се атоми и молекули који су главне компоненте онога што данас знамо као материју.
Горе поменуте честице су обично ући у поступак везивања познат као хемијско везивање, а њих проучава хемија како би разумела хиљаде биолошких процеса који се свакодневно дешавају пред нама, али који се не могу лако уочити. Преко њих су успели да разумеју већину догађаја који свет чине таквим какав јесте.
Шта су хемијске везе?

Све постојеће ствари на свету, укључујући и жива бића, међу којима су и људска бића, сачињене су од споја неких атома и молекула који су одлучили да се придруже кроз процес познат као хемијска веза. Добро је познато да су сви живи организми, па чак и инертни (неживи предмети), сачињени од материје, а то зависи од хемијских веза да би се могли сами створити.
У зависности од тога како су атоми и молекули спојени, могуће је утврдити која врста хемијске везе се третира, а међу најчешћим се могу наћи јонске, ковалентне и металне везе, иако су пронађене две врсте веза. везе које нису баш добро познате када се говори о субјекту, а то су водоничне мостовне везе и Ван дер Ваалс.
Хемијским везама називају се оне силе које чине да два или више атома остану заједно одређено време и које омогућавају пренос електрона између њих.
Процес привлачења који се јавља између два атома претвара се у нешто помало чудно, али ако се анализира са мало пажње, то се врло лако може разумети. Главно што треба знати је да се језгра која имају позитивне наелектрисања одмичу, али истовремено могу бити привучена захваљујући негативно наелектрисаним електронима који се налазе на њиховој површини, а која у неколико наврата може бити већа од силе коју она изазива језгра да се одмакну.
Када се процес хемијског везивања дешава обично, ако не и све време неки атоми губе електроне док други побеђују, али на крају процеса међу свим дејствима може се уочити електрична стабилност.
5 врста хемијских веза
Хемијске везе и неке од њихових карактеристика биће приказане у наставку како би се разумело како функционишу.

Металне везе
У овој врсти везе можете видети како се ствара облак који држи цео скуп атома на окупу, а који се формира од лабавих електрона. У овом процесу се може уочити како се атоми трансформишу у електроне и јоне, уместо да се дешавају онако како би то нормално било, остављајући суседни атом.
Металне везе обично формирају мреже које се сматрају кристалним и имају висок индекс координације.
На лицима ових мрежа можете видети три различите врсте кристалних мрежа које имају различите координационе тачке које се мењају у зависности од тога где се налазе, достижући 12 тачака, 8 тачака и последњу са 6 тачака, без Међутим, каже се да ниво валенције атома метала је увек мали.
Јонске везе
Када говоримо о јонским везама, желимо се осврнути на унију између атома који имају малу електростатичку енергију са онима који имају енергију истог типа већу од првих, а који су обично метални и неметални елемент . Да би се то догодило неопходно је да један од атома може изгубити електроне, а други да их узастопно стиче. Стога се ова веза може описати као процес у коме два атома имају електростатичко привлачење, у којем један учествује са већом привлачношћу, а други са мање привлачности.
Показано је да неметалним елементима недостаје електрон у свом саставу да би могао имати своју потпуну орбиту и из тог разлога постаје пријемник процеса, који се назива анионом.
Метални елементи су познати као катиони јер имају позитиван набој који је супротан анионима, а пошто у последњем свом саставу имају електрон, имају способност везивања за друге атоме, у овом случају неметалне.
Вођени описаним, може се закључити да у овој врсти хемијске везе атоме привлачи електростатичка сила, па анион привлачи катион, и тада се може посматрати када један од атома попусти док друга упија. Када ово једињење остане чврсто, остаје онако како је описано и стабилно, али у тачном тренутку када се стави у влажно окружење или подразумевано у неку течност, они би се поново одвојили, одржавајући своје електричне наелектрисање.
Ковалентне везе
У ковалентним везама, атоми имају способност да привлаче и деле електроне или их апсорбују као у горе поменутим случајевима, и показало се да када се појаве јони су много стабилнији.
Иако се може рећи да већина карика има способност да буду проводници електричне енергије, али у овом случају се испоставља да велики део није. Сва органска материја састоји се од ковалентних веза, јер је, као што је горе поменуто, много стабилнија.
Ове везе имају сопствену поделу која варира у зависности од тога да ли је чиста смеша или не, које су назване поларне везе и оне неполарне чије ће кратко објашњење бити дато у наставку.
Поларна ковалентна веза
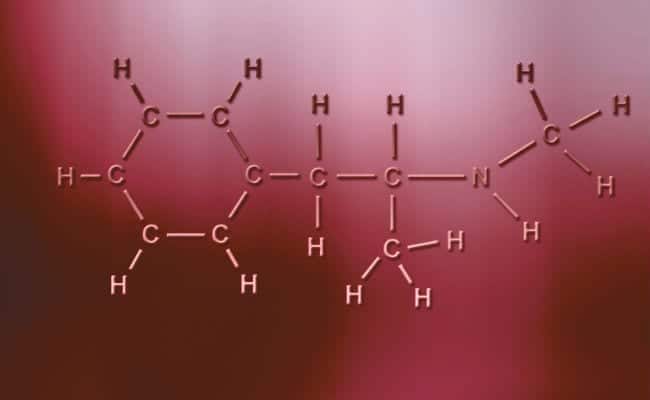
Главна карактеристика поларних ковалентних веза је да су потпуно асиметричне, у смислу да атоми са позитивним или негативним наелектрисањем могу имати два електрона за дељење или два простора за апсорпцију, док други има само један, у зависности од случаја. То се дешава практично исто као и јонске везе, али са једином разликом што се за удруживање атома јавља поларна ковалентна веза. Да би се они појавили, они се морају појавити између два потпуно различита неметална елемента,
Неполарна ковалентна веза
За разлику од горе описане врсте хемијске везе, у овом случају морају постојати два или више атома неметала исте врсте. Ово се у сваком погледу потпуно разликује од поларног, а то се може показати знањем да када два атома истог елемента деле електроне пошто је процес потпуно симетричан, они остају уравнотежени и обојица подједнако примају и донирају електроне.
Водоничне везе
Водоник карактерише то што увек има позитивно наелектрисање, а да би се спровела ова веза неопходно је да га привлачи атом са електронегативним наелектрисањем, што је захваљујући овом процесу могуће посматрати како настаје унија између два на оном који је био деноминован попут водоничног моста одакле потиче назив везе.
Везе до Ван дер Ваалс-а
У овој врсти веза може се наћи унија између два стална дипола, као и између два индукована дипола, или може постојати могућност да се пронађу уније између трајног и индукованог дипола. Једини начин да се то догоди је између два симетрична молекула, која почињу да делују када постоји привлачност или одбојност између молекула или по дефаулту интеракција између јона и молекула.
Захваљујући сталном проучавању које односи се на све врсте постојећих хемијских веза је да је било могуће мало више разумети како материја делује и како се она може трансформисати у потпуно нови производ или се вратити у свој облик након промене у акцији размене електрона како је описано у већини ових процеса.
Сва ова сазнања постигнута су захваљујући напретку технологије, јер се претходно само нагађало о постојању атома, а пример за то је постојање атомских модела великих филозофских мислилаца, иако нису били тако далеко од онога што јесте данас познат, данас је било могуће боље разумети процесе.