Madde, bugün madde olarak bildiğimiz şeyin ana bileşenleri olan atom ve moleküller olarak adlandırılan, insan gözüyle görülemeyen küçük parçacıklardan oluşur.
Yukarıda belirtilen parçacıklar genellikle kimyasal bağlama olarak bilinen bir bağlama sürecine girinve bunlar her gün önümüzde meydana gelen ancak kolayca algılanamayan binlerce biyolojik süreci anlamak için kimya ile incelenir. Onlar aracılığıyla dünyayı olduğu gibi yapan olayların çoğunu anlamayı başardılar.
Kimyasal bağlar nelerdir?

Aralarında insan da bulunan canlılar da dahil olmak üzere dünyada var olan tüm varlıklar, kimyasal bağ olarak bilinen bir süreçle birleşmeye karar veren bazı atom ve moleküllerin birleşmesinden oluşur. Tüm canlı organizmaların ve hatta hareketsiz olanların (cansız nesnelerin) maddeden oluştuğu iyi bilinmektedir ve bu, kendi kendini yaratabilmek için kimyasal bağlara bağlıdır.
Atomların ve moleküllerin nasıl birleştirildiğine bağlı olarak, hangi tür kimyasal bağın işlendiğini belirlemek mümkündür ve en yaygın olanlar arasında iyonik, kovalent ve metalik bağlar bulunabilir, ancak iki tür bağ bulunmuştur. Konuya gelince çok iyi bilinmeyen bağlar, hidrojen köprü bağları ve Van der Waals.
Kimyasal bağlar, iki veya daha fazla atomu belirli bir süre bir arada tutan ve elektronların aralarında geçişine izin veren kuvvetler olarak adlandırılır.
Biraz tuhaf bir şeyde iki atom arasında meydana gelen çekim süreci, ancak biraz dikkatle incelendiğinde çok kolay anlaşılabilir. Bilmeniz gereken en önemli şey, pozitif yüklü çekirdeklerin uzaklaştığıdır, ancak aynı zamanda yüzeylerinde bulunan negatif yüklü elektronlar sayesinde çekilebilirler, bu da birçok durumda sahip olduğu kuvvetten daha büyük olabilir. çekirdeklerin uzaklaşmasına neden olur.
Kimyasal bağlama işlemi her zaman olmasa da genellikle gerçekleştiğinde bazı atomlar elektron kaybeder diğerleri kazanırkenancak sürecin sonunda tüm hareketler arasında elektriksel bir kararlılık gözlemlenebilir.
5 tür kimyasal bağ
Nasıl çalıştıklarını anlamak için kimyasal bağlar ve bazı özellikleri aşağıda gösterilecektir.

Metal bağlantılar
Bu tür bir bağda, gevşek elektronların oluşturduğu tüm atom setini bir arada tutan bir bulutun nasıl yaratıldığını görebilirsiniz. Bu süreçte atomların normalde olduğu gibi olmak yerine, bitişik bir atom bırakarak elektron ve iyonlara nasıl dönüştüğü gözlemlenebilir.
Metalik bağlar genellikle yüksek koordinasyon indeksine sahip kristal olarak kabul edilen ağlar oluşturur.
Bu ağların yüzlerinde, bulundukları yere göre değişen, 12 noktaya, 8 noktaya ve sonuncusu 6 noktaya ulaşan farklı koordinasyon noktalarına sahip üç farklı kristalin ağ türü görebilirsiniz. metal atomlarının değerlik seviyesi her zaman küçüktür.
İyonik bağlar
İyonik bağlardan bahsederken, elektrostatik enerjisi az olan atomlar ile aynı türden enerjiye sahip olanlar, genellikle metalik bir element ve metalik olmayan bir element olan atomlar arasındaki birleşmeye atıfta bulunmak istiyoruz. . Bunun gerçekleşmesi için atomlardan birinin elektron kaybedebilmesi ve diğerinin art arda elektron kazanabilmesi gerekir. Bu nedenle, bu bağ, iki atomun elektrostatik bir çekime sahip olduğu, birinin daha fazla ve diğerinin daha az çekimle katıldığı bir süreç olarak tanımlanabilir.
Metalik olmayan elementlerin, tam yörüngelerine sahip olabilmek için bileşimlerinde bir elektron bulunmadığı ve bu nedenle anyon denilen sürecin alıcısı haline geldiği gösterilmiştir.
Metalik elementler, anyonların zıttı olan pozitif bir yüke sahip oldukları ve bileşimlerinin son kısmında bir elektrona sahip oldukları için diğer atomlara, bu durumda metalik olmayan atomlara bağlanma kabiliyetine sahip oldukları için katyonlar olarak bilinirler.
Açıklananların rehberliğinde, bu tür kimyasal bağda atomların elektrostatik bir kuvvet tarafından çekildiği ve bu nedenle anyonun katyonu çektiği ve atomlardan biri verdiğinde görülebildiği sonucuna varılabilir. diğeri emerken. Bu bileşik katı kaldığında, tarif edildiği gibi ve stabil kalır, ancak tam olarak nemli bir ortama veya varsayılan olarak bir miktar sıvıya yerleştirildiği anda, elektrik yüklerini koruyarak tekrar ayrılırlar.
Kovalent bağlar
Kovalent bağlarda atomlar, yukarıda bahsedilen durumlarda olduğu gibi elektronları çekme ve paylaşma veya absorbe etme kabiliyetine sahiptir ve bunlar meydana geldiğinde iyonların çok daha kararlı olduğu gösterilmiştir.
Bağlantıların çoğunun elektrik iletkeni olma kapasitesine sahip olduğu söylenebilir, ancak bu durumda büyük bir kısmının olmadığı ortaya çıkıyor. Tüm organik maddeler kovalent bağlardan oluşur, çünkü yukarıda belirtildiği gibi çok daha kararlıdır.
Bu bağların, saf bir karışım olup olmamasına bağlı olarak değişen, polar bağlar ve polar olmayan bağlar olarak adlandırılan ve aşağıda kısa bir açıklaması verilecek olan kendi bölümleri vardır.
Polar kovalent bağ
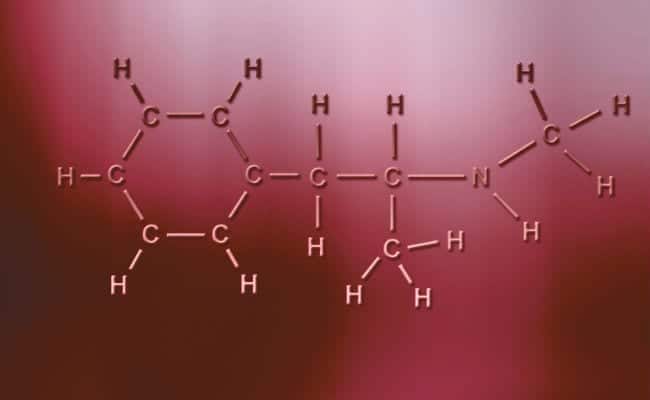
Kutupsal kovalent bağların temel özelliği, pozitif veya negatif yüklü atomların paylaşacak iki elektrona veya soğurmak için iki boşluğa sahip olması ve diğerinin durumları değiştirerek yalnızca bir elektrona sahip olması anlamında tamamen asimetrik olmalarıdır. Bunlar, pratik olarak iyonik bağlarla aynı şekilde gerçekleşir, ancak atomların birleşmesi için tek farkla, polar bir kovalent bağ oluşur. Bunların oluşması için tamamen farklı iki metalik olmayan element arasında meydana gelmeleri gerekir,
Polar olmayan kovalent bağ
Yukarıda açıklanan kimyasal bağ türünden farklı olarak, bu durumda aynı tipte ametalden iki veya daha fazla atom bulunmalıdır. Bu, her yönden kutupsaldan tamamen farklıdır ve bu, aynı elementin iki atomunun elektronları paylaştığı zaman, süreç tamamen simetrik olduğu için, dengede kaldıkları ve her ikisinin de eşit olarak elektron alıp verdiklerinin bilinmesiyle gösterilebilir.
Hidrojen bağları
Hidrojen, her zaman pozitif bir yüke sahip olmasıyla karakterize edilir ve bu bağı gerçekleştirmek için elektronegatif yüklü bir atom tarafından çekilmesi gerekir, bu işlem sayesinde, bu işlem sayesinde aralarında bir birliğin nasıl oluştuğunu gözlemlemek mümkündür. iki tanesi, bağın adının geldiği yer olan bir hidrojen köprüsü gibi adlandırılmıştı.
Van der Waals'a bağlantılar
Bu tür bağlantılarda, iki kalıcı dipol arasındaki birlikteliğin yanı sıra iki indüklenmiş dipol arasında birleşme bulunabilir veya kalıcı ve indüklenmiş bir dipol arasında birliğin bulunması olasılığı olabilir. Bunun gerçekleşmesinin tek yolu, moleküller arasında bir çekim veya itme olduğunda veya varsayılan olarak iyonlar ve moleküller arasındaki etkileşim olduğunda hareket etmeye başlayan iki simetrik molekül arasındadır.
Sürekli çalışma sayesinde mevcut tüm kimyasal bağlar için geçerlidir bu süreçlerin çoğunda anlatıldığı gibi, maddenin nasıl çalıştığını ve tamamen yeni bir ürüne nasıl dönüştürülebileceğini veya bir elektron değişim eyleminde değiştikten sonra şekline nasıl dönebileceğini biraz daha anlamak mümkün olmuştur.
Tüm bu bilgi, teknolojinin ilerlemesi sayesinde elde edilmiştir, çünkü daha önce yalnızca atomların varlığı hakkında spekülasyon yapılmıştı ve bunun bir örneği, büyük felsefi düşünürlerin atom modellerinin varlığıdır, ancak ne olduğundan çok uzak olmasalar da Günümüzde bilinen süreçleri daha iyi anlamak günümüzde mümkün olmuştur.