Матерія складається з невидимих для людського ока дрібних частинок, які називали атомами та молекулами, що є головними компонентами того, що ми сьогодні знаємо як матерію.
Вищезазначені частинки зазвичай є ввести процес скріплення, відомий як хімічне зв’язування, і вони вивчаються хімією, щоб зрозуміти тисячі біологічних процесів, які відбуваються щодня перед нами, але які неможливо легко сприйняти. Саме завдяки їм їм вдалося зрозуміти більшість подій, які роблять світ таким, яким він є.
Що таке хімічні зв’язки?

Всі існуючі речі у світі, включаючи живі істоти, серед яких є люди, складаються з об'єднання деяких атомів і молекул, які вирішили приєднатися через процес, відомий як хімічний зв'язок. Загальновідомо, що всі живі організми і навіть інертні (неживі предмети) складаються з речовини, і це залежить від хімічних зв’язків, щоб мати можливість створювати себе.
Залежно від способу з’єднання атомів і молекул, можна визначити, який тип хімічного зв’язку обробляється, і серед найпоширеніших можна знайти іонні, ковалентні та металеві зв’язки, хоча було знайдено два типи зв’язків. зв’язки, які не дуже відомі при розмові про предмет, а саме водневі мостові зв’язки та Ван дер Ваальса.
Хімічними зв’язками називаються ті сили, які змушують два або більше атомів залишатися разом протягом певного часу і які дозволяють передавати електрони між собою.
Процес притягання, який відбувається між двома атомами, перетворюється на щось дивне, але якщо його проаналізувати з невеликою увагою, це можна зрозуміти дуже легко. Головне, що потрібно знати, це те, що ядра, які мають позитивні заряди, віддаляються, але в той же час вони можуть бути притягнуті завдяки електронам з негативним зарядом, які знаходяться на їх поверхні, що в декілька разів може бути більшою за силу, яку вона змушує ядра віддалятися.
Коли процес хімічного зв’язку відбувається зазвичай, якщо не весь час деякі атоми втрачають електрони тоді як інші перемагають, але в кінці процесу серед усіх дій може спостерігатися електрична стабільність.
П’ять типів хімічних зв’язків
Хімічні зв’язки та деякі їх характеристики будуть показані нижче, щоб зрозуміти, як вони працюють.

Металеві ланки
У цьому типі зв’язків ви можете бачити, як створюється хмара, яка утримує весь набір атомів разом, який утворений вільними електронами. У цьому процесі можна спостерігати, як атоми перетворюються на електрони та іони, замість того, щоб відбуватися так, як це було б зазвичай, залишаючи сусідній атом.
Металеві зв’язки зазвичай утворюють мережі, що вважаються кристалічними, що мають високий індекс координації.
На гранях цих мереж ви можете побачити три різні типи кристалічних мереж, які мають різні точки координації, які змінюються залежно від того, де вони знаходяться, досягаючи 12 точок, 8 точок і останню з 6 точками, без. Однак сказано, що рівень валентності атомів металу завжди невеликий.
Іонні зв’язки
Коли ми говоримо про іонні зв’язки, ми хочемо звернутися до об’єднання між атомами, які мають невелику електростатичну енергію, з тими, що мають енергію того ж типу, більшу за перші, які, як правило, є металевим елементом і неметалевим елементом . Щоб це сталося, необхідно, щоб один з атомів міг втратити електрони, а інший - отримати їх послідовно. Отже, цей зв’язок можна описати як процес, в якому два атоми мають електростатичне притягання, в якому один бере участь із більшим притяганням, а інший з меншим притяганням.
Було показано, що неметалевим елементам не вистачає електрона у своєму складі, щоб мати свою повну орбіту, і саме з цієї причини він стає приймачем процесу, який називається аніоном.
Металеві елементи відомі як катіони, оскільки вони мають позитивний заряд, протилежний аніонам, і оскільки вони мають електрон в останньому складі, вони мають здатність зв’язуватися з іншими атомами, в даному випадку неметалевими.
Керуючись описаним, можна зробити висновок, що в цьому типі хімічного зв’язку атоми притягуються електростатичною силою, а отже аніон притягує катіон, і він є там, коли це можна спостерігати, коли один з атомів дає тоді як інша поглинає. Коли ця сполука залишається твердою, вона залишається такою, як описана, і стабільною, але саме в той момент, коли її поміщають у вологе середовище або за замовчуванням у якусь рідину, вони знову відокремлюються, підтримуючи свої електричні заряди.
Ковалентні зв’язки
У ковалентних зв’язках атоми мають здатність залучати і ділитися електронами або поглинати їх, як у згаданих вище випадках, і було показано, що коли вони відбуваються, іони набагато стабільніші.
Хоча можна сказати, що більшість ланок мають здатність бути провідниками електрики, але в цьому випадку виявляється, що більша частина не є. Вся органічна речовина складається з ковалентних зв’язків, оскільки, як уже згадувалося вище, вона набагато стабільніша.
Ці зв’язки мають власний розподіл, який змінюється залежно від того, чиста це суміш чи ні, які називали полярними зв’язками, і неполярні, коротке пояснення яких буде дано нижче.
Полярний ковалентний зв’язок
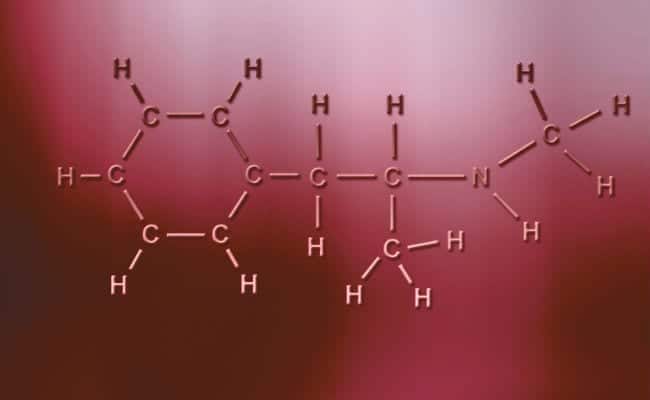
Основна характеристика полярних ковалентних зв'язків полягає в тому, що вони абсолютно асиметричні, в тому сенсі, що атоми з позитивним або негативним зарядом можуть мати два електрони для спільного використання або два простори для поглинання, тоді як інші мають лише один, залежно від випадків. Вони трапляються практично так само, як іонні зв’язки, але з тією лише різницею, що для об’єднання атомів відбувається полярний ковалентний зв’язок. Щоб вони мали місце, вони повинні відбуватися між двома абсолютно різними неметалевими елементами,
Неполярний ковалентний зв’язок
На відміну від типу хімічного зв’язку, описаного вище, у цьому випадку має бути два або більше атомів неметалу одного типу. Це абсолютно не відрізняється від полярного, і це можна продемонструвати, знаючи, що коли два атоми одного і того ж елемента ділять електрони, оскільки процес повністю симетричний, вони залишаються збалансованими і обидва приймають і віддають електрони однаково.
Водневі зв’язки
Водень характеризується тим, що завжди має позитивний заряд, і для здійснення цього зв’язку необхідно, щоб його притягував атом з електронегативним зарядом, який завдяки цьому процесу дає змогу спостерігати, як утворюється союз між два на той, що був позначений як водневий міст, звідки походить назва зв'язку.
Посилання на Ван дер Ваальса
У цьому типі зв'язків може бути знайдений союз між двома постійними диполями, а також між двома індукованими диполями, або може існувати можливість виявлення об'єднань між постійним і індукованим диполем. Єдиний спосіб, щоб це сталося - це між двома симетричними молекулами, які починають діяти, коли між молекулами виникає притягання чи відштовхування або за замовчуванням взаємодія між іонами та молекулами.
Завдяки постійному вивченню того застосовується до всіх типів існуючих хімічних зв’язків полягає в тому, що вдалося трохи більше зрозуміти, як працює речовина і як її можна перетворити на абсолютно новий продукт або повернути свою форму після зміни в процесі обміну електронами, як описано в більшості цих процесів.
Всі ці знання були досягнуті завдяки прогресу технологій, оскільки раніше про існування атомів лише припускали, і прикладом цього є існування атомних моделей великих філософських мислителів, хоча вони були не так далеко від того, що є відомі сьогодні, сьогодні вдалося краще зрозуміти процеси.