La matèria està conformat per petites partícules que són invisibles per a l'ull humà, a les quals se'ls va denominar com àtoms i molècules que són els principals components del que avui coneixem com la matèria.
Les partícules abans esmentades solen entrar en un procés d'unió a el qual se li coneix com enllaços químics, I aquests són estudiats per la química per poder comprendre els milers de processos biològics que ocorren diàriament al davant de nosaltres però que no poden ser percebuts amb facilitat. Per mitjà d'ells és que s'han aconseguit comprendre la majoria dels successos que fan el món com és.
Què són els enllaços químics?

Totes les coses existents al món incloent els éssers vius, entre els quals hi ha els éssers humans estan conformades per la unió d'alguns àtoms i molècules que decideixen unir-se mitjançant un procés a el qual se li coneix com un enllaç químic. És ben sabut que tots els organismes vivents i fins i tot els inerts (objectes inanimats) estan conformats per la matèria, i aquesta depèn dels enllaços químics per poder crear-se.
Depenent de com s'uneixen els àtoms i les molècules és que es pot determinar quin tipus d'enllaç químic s'està tractant, i entre els més comuns es poden trobar als enllaços iònics, els covalents i els metàl·lics, encara que s'han trobat dos tipus de enllaços nous que no són molt coneguts quan es parla del tema, que són els enllaços per pont d'hidrogen i els Van der Waals.
Els enllaços químics s'anomenen com aquelles forces que fan que es mantinguin units dos o més àtoms per un temps determinat, i que permet la transmissió d'electrons entre ells.
El procés d'atracció que ocorre entre els dos àtoms en una cosa una mica estrany però que si s'analitza amb una mica d'atenció es pot comprendre amb molta facilitat. El més important que cal saber és que els nuclis que posseeixen càrregues positives s'allunyen, però alhora es poden veure atrets gràcies als electrons amb càrrega negativa que es troben en la seva superfície, que en diverses ocasions pot ser més gran que la força que fa que s'allunyin dels nuclis.
Quan succeeix el procés dels enllaços químics usualment, per no dir tot el temps uns àtoms perden electrons mentre que altres els van guanyant, Però a la fi de l'procés es pot observar una estabilitat elèctrica entre tota l'acció.
Els 5 tipus d'enllaços químics
A continuació es mostraran els enllaços químics i algunes de les seves característiques per poder comprendre com és el seu funcionament.

Enllaços metàl·lics
En aquest tipus d'enllaços es pot observar com es crea un núvol que manté unit a tot el conjunt d'àtoms, la qual és formada pels electrons solts. Es pot observar en aquest procés com els àtoms es transformen en electrons i ions, en lloc de succeir com seria normalment quedant un àtom adjacent.
Els enllaços metàl·lics solen formar xarxes considerades cristal·lines, les quals posseeixen un alt índex de coordinació.
A les cares d'aquestes xarxes es poden observar tres tipus diferents de xarxes cristal·lines, les quals tenen diferents punts de coordinació que van canviant depenent de el lloc en el qual es trobin arribant a tenir 12 punts, 8 punts i l'última amb 6 punts, sense això es diu que el nivell de valència dels àtoms metàl·lics sempre és petit.
Enllaços iònics
Quan s'està parlant d'enllaços iònics es vol referir a la unió entre àtoms que tenen poca energia electrostàtica amb els que posseeixen una energia de el mateix tipus més gran que les primeres, que usualment són un element metàl·lic i un no metàl·lic. Perquè això passi cal que un dels àtoms pugui perdre electrons, i que l'altre pugui guanyar-los consecutivament. Per tant es pot descriure aquest enllaç com un procés en el qual dos àtoms posseeixen una atracció electrostàtica, en la qual participen un amb major atracció i l'altre amb menor atracció.
Es va demostrar que als elements no metàl·lics els falta un electró en la seva composició per poder tenir la seva òrbita completa i és per aquest motiu que el mateix es converteix en receptor de el procés, a el qual se li denomina com un anió.
Els elements metàl·lics es coneixen com els cations pel fet que posseeixen una càrrega positiva que és el contrari als anions, i com posseeixen un electró en l'últim de la seva composició tenen la capacitat d'unir-se a altres àtoms, en aquest cas els no metàl·lics.
Guiant-se per la qual cosa s'ha descrit es pot deduir que en aquest tipus d'enllaç químic dels àtoms s'atrauen per una força electrostàtica, i per tant l'anió atrau el catió, i és allà quan es pot observar quan un dels àtoms cedeix mentre que l'altre absorbeix. Quan aquest compost es manté sòlid es manté com s'ha descrit i estable, però a el precís moment que és posat en un ambient humit o en per defecte en algun líquid tornarien a separar-se mantenint les seves càrregues elèctriques.
Enllaços covalents
En els enllaços covalents dels àtoms tenen la capacitat d'atreure i compartir els electrons o d'absorbir com en els casos abans esmentats, i s'ha pogut demostrar que quan aquests ocorren els ions són molt més estables.
Encara que es pot dir que la majoria dels enllaços tenen una capacitat de ser conductors d'electricitat, però en aquest cas resulta que una gran part no ho és. Tota la matèria orgànica està conformada per enllaços covalents, ja que com es va esmentar anteriorment aquesta és molt més estable.
Aquests enllaços tenen la seva pròpia divisió que varia depenent de si és una barreja pura o no, els quals s'han denominat com enllaços polars i els no polars dels quals es donarà una breu explicació a continuació
Enllaç covalent polar
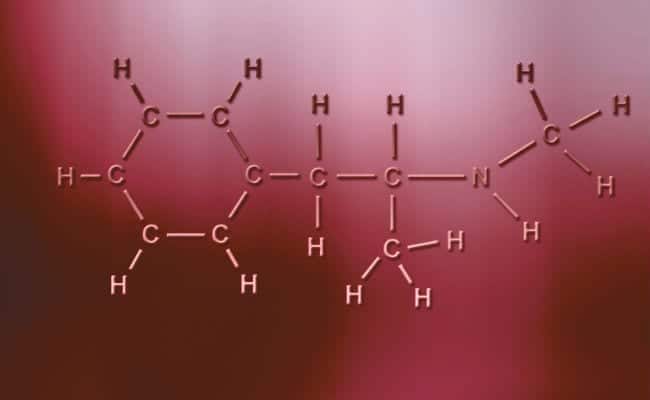
Els enllaços covalents polars tenen com a principal característica que són totalment asimètrics, en el sentit que els àtoms amb càrrega positiva o negativa poden tenir dos electrons per compartir o dos espais per absorbir mentre que l'altre només en té un variant els casos. Aquests succeeixen pràcticament a l'igual que els enllaços iònics però amb l'única diferència que perquè els àtoms s'uneixin succeeix un enllaç covalent polar. Perquè aquests tinguin lloc han de donar-se entre dos elements no metàl·lics totalment diferents,
Enllaç covalent no polar
A diferència de l'tipus d'enllaç químic descrit anteriorment en aquest cas han d'haver dos o més àtoms d'un no metall de el mateix tipus. Aquest és totalment diferent a l'polar en tots els sentits, i això es pot demostrar a l'conéixer que quan dos àtoms d'un mateix element es comparteixen electrons a l'ésser totalment simètric el procés, es mantenen equilibrats i tots dos reben i donen electrons per igual.
Enllaços de ponts d'hidrogen
L'hidrogen es caracteritza per sempre tenir una càrrega positiva, i per poder dur-se a terme aquest enllaç cal que el mateix es vegi atret per un àtom amb càrrega electronegativa, que gràcies a aquest procés es pot observar com es forma una unió entre tots dos a la qual es va denominar com un pont d'hidrogen que és d'on deriva el nom de l'enllaç.
Enllaços de Van der Waals
En aquest tipus d'enllaços es pot trobar la unió entre dos dipols permanents, així com també entre dos dipols induïts o pot existir la possibilitat que es trobin unions entre un dipol permanent i un induït. L'única manera de que això passi és entre dues molècules simètriques, les quals comencen a actuar quan hi ha una atracció o repulsió entre molècules o per defecte la interacció entre uns ions i les molècules.
Gràcies a l'constant estudi que se li aplica a tots els tipus d'enllaços químics existents és que s'ha pogut comprendre una mica més el funcionament de la matèria i com aquesta pot transformar-se en un producte totalment nou o tornar al seu forma després de canviar en una acció d'intercanvi d'electrons i que figura a la majoria d'aquests processos.
Tots aquests coneixements s'han aconseguit aconseguir gràcies a l'avanç que ha tingut la tecnologia, ja que anteriorment només s'especulava de l'existència dels àtoms i un exemple d'això és l'existència dels models atòmics de grans pensadors filosòfics, encara que ells no estaven tan lluny del que es coneix avui dia, en l'actualitat s'ha pogut comprendre millor els processos.