Materiale består af små partikler, der er usynlige for det menneskelige øje, som kaldes atomer og molekyler, der er hovedkomponenterne i det, vi i dag kender som stof.
De førnævnte partikler er normalt gå ind i en limningsproces kendt som kemisk binding, og disse studeres af kemi for at forstå de tusinder af biologiske processer, der optræder dagligt foran os, men som ikke let kan opfattes. Det er gennem dem, at de har formået at forstå de fleste af de begivenheder, der gør verden, som den er.
Hvad er kemiske bindinger?

Alle eksisterende ting i verden inklusive levende væsener, blandt hvilke mennesker, består af foreningen af nogle atomer og molekyler, der beslutter at slutte sig til gennem en proces kendt som en kemisk binding. Det er velkendt, at alle levende organismer og endda inaktive (livløse objekter) består af stof, og dette afhænger af kemiske bindinger for at være i stand til at skabe sig selv.
Afhængigt af hvordan atomerne og molekylerne er forbundet, er det muligt at bestemme, hvilken type kemisk binding der behandles, og blandt de mest almindelige findes ioniske, kovalente og metalliske bindinger, selvom der er fundet to typer bindinger. bindinger, der ikke er særlig velkendte, når det kommer til emnet, som er hydrogenbrobindinger og Van der Waals.
Kemiske bindinger kaldes de kræfter, der danner to eller flere atomer, forbliver sammen i en bestemt tid, og som muliggør transmission af elektroner imellem dem.
Processen med tiltrækning, der opstår mellem de to atomer i noget lidt underligt, men at hvis det analyseres med lidt opmærksomhed, kan det forstås meget let. Det vigtigste at vide er, at kernerne, der har positive ladninger, bevæger sig væk, men på samme tid kan de tiltrækkes takket være elektronerne med negativ ladning, der er på deres overflade, hvilket ved flere lejligheder kan være større end den kraft, det får kernerne til at bevæge sig væk.
Når den kemiske bindingsproces sker normalt, hvis ikke hele tiden nogle atomer mister elektroner mens andre vinder, men i slutningen af processen kan der observeres en elektrisk stabilitet mellem al handlingen.
De 5 typer kemiske bindinger
De kemiske bindinger og nogle af deres egenskaber vises nedenfor for at forstå, hvordan de fungerer.

Metal links
I denne type binding kan du se, hvordan der oprettes en sky, der holder hele atomsættet sammen, som er dannet af de løse elektroner. Det kan observeres i denne proces, hvordan atomer omdannes til elektroner og ioner i stedet for at ske som det normalt ville være, efterlader et tilstødende atom.
Metalliske bindinger danner normalt netværk, der betragtes som krystallinske, og som har et højt koordineringsindeks.
På disse netværks ansigter kan du se tre forskellige typer krystallinske netværk, der har forskellige koordineringspunkter, der ændrer sig afhængigt af hvor de er, når 12 point, 8 point og de sidste med 6 point uden dog siges det, at valensniveau af metalatomer er altid lille.
Ioniske bindinger
Når vi taler om ionbindinger, vil vi henvise til foreningen mellem atomer, der har lidt elektrostatisk energi med dem, der har en energi af samme type større end de første, som normalt er et metalelement og et ikke-metallisk element . For at dette kan ske, er det nødvendigt, at et af atomerne kan miste elektroner, og at det andet kan få dem fortløbende. Derfor kan denne binding beskrives som en proces, hvor to atomer har en elektrostatisk tiltrækning, hvor den ene deltager med større tiltrækning og den anden med mindre tiltrækning.
Det blev vist, at ikke-metalliske elementer mangler en elektron i deres sammensætning for at kunne have deres komplette bane, og det er af denne grund, at det bliver en modtager af processen, der kaldes en anion.
Metalliske elementer er kendt som kationer, fordi de har en positiv ladning, der er det modsatte af anioner, og da de har en elektron i den sidste af deres sammensætning, har de evnen til at binde til andre atomer, i dette tilfælde ikke-metalliske.
Styret af det, der er beskrevet, kan det udledes, at i denne type kemisk binding tiltrækkes atomerne af en elektrostatisk kraft, og derfor tiltrækker anionen kationen, og den er der, når den kan observeres, når et af atomerne giver mens den anden absorberer. Når denne forbindelse forbliver fast, forbliver den som beskrevet og stabil, men i det nøjagtige øjeblik, den placeres i et fugtigt miljø eller som standard i en eller anden væske, adskiller de sig igen og opretholder deres elektriske ladninger.
Kovalente bindinger
I kovalente bindinger har atomer evnen til at tiltrække og dele elektroner eller absorbere dem som i de ovennævnte tilfælde, og det er blevet vist, at ionerne er meget mere stabile, når disse forekommer.
Selvom det kan siges, at de fleste af forbindelserne har kapacitet til at være ledere af elektricitet, men i dette tilfælde viser det sig, at en stor del ikke er det. Alt organisk materiale består af kovalente bindinger, da det som nævnt ovenfor er meget mere stabilt.
Disse obligationer har deres egen opdeling, der varierer afhængigt af, om det er en ren blanding eller ej, der er blevet kaldt polære bindinger og ikke-polære bindinger, hvoraf en kort forklaring vil blive givet nedenfor.
Polær kovalent binding
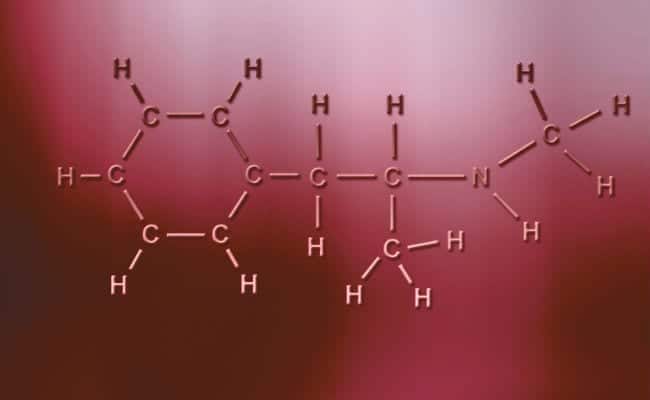
Hovedkarakteristikken ved polære kovalente bindinger er, at de er totalt asymmetriske, i den forstand at atomer med en positiv eller negativ ladning kan have to elektroner at dele eller to mellemrum at absorbere, mens den anden kun har en, der varierer tilfældene. Disse sker praktisk talt det samme som ionbindinger, men med den eneste forskel at der for atomer at forene sig, opstår en polær kovalent binding. For at disse skal forekomme, skal de forekomme mellem to helt forskellige ikke-metalliske elementer,
Ikke-polær kovalent binding
I modsætning til den ovenfor beskrevne type kemisk binding skal der i dette tilfælde være to eller flere atomer af en ikke-metal af samme type. Dette er helt forskelligt fra polar på alle måder, og dette kan demonstreres ved at vide, at når to atomer af det samme element deler elektroner, da processen er totalt symmetrisk, forbliver de afbalancerede og begge modtager og donerer elektroner ens.
Hydrogenbindingsbindinger
Brint er karakteriseret ved altid at have en positiv ladning, og for at udføre denne binding er det nødvendigt, at det tiltrækkes af et atom med en elektronegativ ladning, hvilket takket være denne proces er det muligt at observere, hvordan en union dannes mellem to på den ene, der blev denomineret som en brintbro, hvorfra bindingen kommer.
Links til Van der Waals
I denne type forbindelser kan forbindelsen mellem to permanente dipoler findes såvel som mellem to inducerede dipoler, eller der kan være muligheden for, at fagforeninger vil blive fundet mellem en permanent og en induceret dipol. Den eneste måde, hvorpå dette kan ske, er mellem to symmetriske molekyler, som begynder at virke, når der er en tiltrækning eller frastødning mellem molekyler eller som standard interaktionen mellem ioner og molekyler.
Takket være den konstante undersøgelse, der gælder for alle typer eksisterende kemiske bindinger er, at det har været muligt at forstå lidt mere, hvordan materie fungerer, og hvordan det kan omdannes til et helt nyt produkt eller vende tilbage til dets form efter ændring i en elektronudvekslingshandling, som beskrevet i de fleste af disse processer.
Al denne viden er opnået takket være den teknologiske udvikling, da det tidligere kun blev spekuleret om eksistensen af atomer, og et eksempel på dette er eksistensen af atomodellerne for store filosofiske tænkere, skønt de ikke var så langt fra det, der er kendt i dag, i dag har det været muligt at forstå processerne bedre.