Aine koostuu pienistä ihmissilmälle näkymättömistä hiukkasista, joita kutsuttiin atomeiksi ja molekyyleiksi, jotka ovat tärkeimmät komponentit sille, mitä tunnemme tänään aineena.
Edellä mainitut hiukkaset ovat yleensä aloittaa sitoutumisprosessin, joka tunnetaan nimellä kemiallinen sidos, ja näitä kemia tutkii ymmärtääkseen tuhansia biologisia prosesseja, joita tapahtuu päivittäin edessämme, mutta joita ei voida helposti havaita. Heidän kauttaan he ovat onnistuneet ymmärtämään suurimman osan tapahtumista, jotka tekevät maailmasta sellaisenaan.
Mitä ovat kemialliset sidokset?

Kaikki maailman olemassa olevat asiat, mukaan lukien elävät olennot, joiden joukossa ovat myös ihmiset, koostuvat joidenkin atomien ja molekyylien yhdistyksestä, jotka päättävät liittyä kemiallisena sidoksena tunnetun prosessin kautta. Tiedetään hyvin, että kaikki elävät organismit ja jopa inertit (elämättömät esineet) koostuvat aineesta, ja tämä riippuu kemiallisista sidoksista voidakseen luoda itsensä.
Atomien ja molekyylien liittymisestä riippuen on mahdollista määrittää, minkä tyyppistä kemiallista sidosta käsitellään, ja yleisimpien joukossa löytyy ionisia, kovalentteja ja metallisia sidoksia, vaikka kahden tyyppisiä sidoksia on löytynyt. sidokset, jotka eivät ole kovin hyvin tunnettuja, kun kyse on aiheesta, jotka ovat vety-sillan sidokset ja Van der Waals.
Kemiallisia sidoksia kutsutaan voimiksi, jotka saavat kaksi tai useampia atomeja pysymään yhdessä tietyn ajan ja jotka mahdollistavat elektronien siirtymisen niiden välillä.
Kahden atomin välinen vetovoima muuttuu hieman outoksi, mutta jos sitä analysoidaan pienellä huomiolla, se voidaan ymmärtää helposti. Tärkeintä on tietää, että positiiviset varaukset sisältävät ytimet siirtyvät pois, mutta samalla ne voivat vetää puoleensa niiden pinnalla olevien negatiivisesti varautuneiden elektronien ansiosta, jotka voivat useaan otteeseen olla suurempia kuin sen aiheuttama voima ytimet siirtyä pois.
Kun kemiallinen sitoutumisprosessi tapahtuu yleensä, ellei koko ajan jotkut atomit menettävät elektroneja kun taas toiset voittavat, mutta prosessin lopussa voidaan havaita sähköinen vakaus kaikkien toimintojen joukossa.
Viiden tyyppiset kemialliset sidokset
Kemialliset sidokset ja jotkut niiden ominaisuuksista esitetään alla niiden toiminnan ymmärtämiseksi.

Metallilinkit
Tämän tyyppisessä sidoksessa voit nähdä, kuinka muodostuu pilvi, joka pitää kiinni koko atomiryhmän, jonka löysät elektronit muodostavat. Tässä prosessissa voidaan havaita, kuinka atomit muuttuvat elektroniksi ja ioneiksi sen sijaan, että tapahtuisivat normaalisti, jättäen viereisen atomin.
Metallisidokset muodostavat yleensä kiteisiksi katsottuja verkkoja, joilla on korkea koordinaatioindeksi.
Näiden verkkojen pinnoilla voit nähdä kolme erityyppistä kiteistä verkkoa, joilla on erilaiset koordinaatiopisteet, jotka vaihtelevat sijaintiensa mukaan, saavuttaen 12 pistettä, 8 pistettä ja viimeisen 6 pistettä, ilman sanotaan kuitenkin, että metalliatomien valenssitaso on aina pieni.
Ioniset sidokset
Kun puhumme ionisidoksista, haluamme viitata atomien, joilla on vähän sähköstaattista energiaa, yhteenliittymiseen niiden kanssa, joiden saman tyyppinen energia on suurempi kuin ensimmäiset, jotka ovat yleensä metallielementti ja ei-metallielementti . Tämän tapahtuessa on välttämätöntä, että toinen atomeista voi menettää elektroneja ja toinen voi saada ne peräkkäin. Siksi tätä sidosta voidaan kuvata prosessina, jossa kahdella atomilla on sähköstaattinen vetovoima, jossa toinen osallistuu suuremmalla vetovoimalla ja toinen vähemmän vetovoimalla.
Osoitettiin, että ei-metallisista elementeistä puuttuu elektroni koostumuksestaan voidakseen saavuttaa täydellisen kiertoradansa, ja tästä syystä siitä tulee prosessin vastaanottaja, jota kutsutaan anioniksi.
Metalli-elementtejä kutsutaan kationeiksi, koska niillä on positiivinen varaus, joka on päinvastainen anioneille, ja koska niiden viimeisessä koostumuksessa on elektroni, niillä on kyky sitoutua muihin atomeihin, tässä tapauksessa ei-metallisiin.
Kuvatun perusteella voidaan päätellä, että tämän tyyppisessä kemiallisessa sidoksessa atomeja houkuttelee sähköstaattinen voima, ja siksi anioni houkuttelee kationia, ja silloin kun se voidaan havaita, kun yksi atomista tuottaa toinen imee. Kun tämä yhdiste pysyy kiinteänä, se pysyy kuvatulla tavalla ja vakaana, mutta tarkan ajankohtana se asetetaan kosteaan ympäristöön tai oletusarvoisesti johonkin nesteeseen, ne erotuisivat jälleen ylläpitämällä sähkövarojaan.
Kovalenttiset sidokset
Kovalenttisissa sidoksissa atomeilla on kyky houkutella ja jakaa elektroneja tai absorboida niitä kuten edellä mainituissa tapauksissa, ja on osoitettu, että näiden tapahtuessa ionit ovat paljon vakaampia.
Vaikka voidaan sanoa, että useimmilla linkeillä on kyky olla sähkönjohtimia, mutta tässä tapauksessa käy ilmi, että suuri osa ei ole. Kaikki orgaaniset aineet koostuvat kovalenttisista sidoksista, koska kuten edellä mainittiin, se on paljon vakaampi.
Näillä sidoksilla on oma jakautumisensa, joka vaihtelee sen mukaan, onko kyseessä puhdas seos vai ei. Niitä on kutsuttu polaarisiksi sidoksiksi ja ei-polaarisiksi sidoksiksi, joista annetaan lyhyt selitys alla.
Polaarinen kovalenttinen sidos
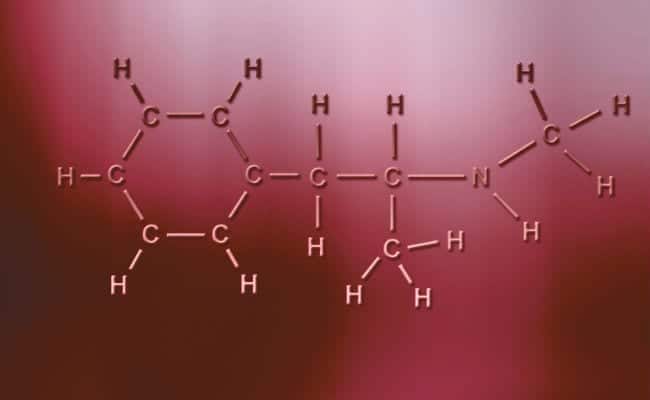
Polaaristen kovalenttisten sidosten pääominaisuus on, että ne ovat täysin epäsymmetrisiä siinä mielessä, että positiivisilla tai negatiivisilla varauksilla varustetuilla atomilla voi olla kaksi elektronia jakamista varten tai kaksi tilaa absorboimiseksi, kun taas toisella on vain yksi tapauksia vaihdellen. Nämä tapahtuvat käytännössä samoin kuin ionisidokset, mutta sillä ainoalla erolla, että atomien yhdistämiseksi tapahtuu polaarinen kovalenttinen sidos. Jotta nämä tapahtuisivat, niiden on tapahduttava kahden täysin erilaisen ei-metallisen elementin välillä,
Ei-polaarinen kovalenttinen sidos
Toisin kuin edellä kuvattu kemiallisen sidoksen tyyppi, tässä tapauksessa on oltava vähintään kaksi saman tyyppistä ei-metallista atomia. Tämä eroaa kaikin tavoin täysin napaisuudesta, ja tämä voidaan osoittaa tietämällä, että kun kaksi saman elementin atomia jakavat elektroneja, koska prosessi on täysin symmetrinen, ne pysyvät tasapainossa ja molemmat vastaanottavat ja luovuttavat elektroneja yhtä paljon.
Vety sidokset
Vety on tunnettu siitä, että sillä on aina positiivinen varaus, ja tämän sidoksen toteuttamiseksi on välttämätöntä, että se vetää atomia elektronegatiivisella varauksella, mikä tämän prosessin ansiosta on mahdollista havaita, kuinka muodostuu liitos kaksi, joka oli nimeltään vety-silta, josta sidoksen nimi on peräisin.
Linkit Van der Waalsiin
Tämän tyyppisessä linkissä voidaan löytää yhteys kahden pysyvän dipolin välillä, samoin kuin kahden indusoidun dipolin välillä, tai voi olla mahdollista, että linkkejä löytyy pysyvän ja indusoidun dipolin välillä. Ainoa tapa tähän tapahtuu kahden symmetrisen molekyylin välillä, jotka alkavat toimia, kun molekyylien välillä on vetovoima tai vastenmielisyys tai oletuksena ionien ja molekyylien välinen vuorovaikutus.
Kiitos jatkuvasta tutkimuksesta koskee kaikentyyppisiä olemassa olevia kemiallisia sidoksia on, että on ollut mahdollista ymmärtää hieman enemmän, miten aine toimii ja kuinka se voidaan muuntaa täysin uudeksi tuotteeksi tai palata muotoonsa sen jälkeen, kun se on muuttunut elektroninvaihtotoiminnossa, kuten useimmissa näistä prosesseista on kuvattu.
Kaikki tämä tieto on saavutettu tekniikan edistymisen ansiosta, koska aiemmin vain spekuloitiin atomien olemassaoloa, ja esimerkkinä tästä on suurten filosofisten ajattelijoiden atomimallien olemassaolo, vaikka ne eivät olleetkin kaukana siitä, mikä on tunnetaan nykyään, tänään on ollut mahdollista ymmärtää paremmin prosesseja.