Materija susideda iš mažų žmogaus akiai nematomų dalelių, kurios buvo vadinamos atomais ir molekulėmis, kurios yra pagrindiniai komponentai to, ką šiandien žinome kaip materiją.
Minėtos dalelės paprastai yra pradėti jungimo procesą, vadinamą cheminiu sujungimuir juos tiria chemija, kad suprastų tūkstančius biologinių procesų, kurie kasdien vyksta priešais mus, tačiau jų neįmanoma lengvai suvokti. Per juos jiems pavyko suprasti daugumą įvykių, kurie daro pasaulį tokį, koks jis yra.
Kas yra cheminiai ryšiai?

Visi pasaulyje egzistuojantys dalykai, įskaitant gyvas būtybes, tarp kurių yra ir žmonės, susideda iš kai kurių atomų ir molekulių, nusprendusių prisijungti, proceso, vadinamo cheminiu ryšiu, sąjungos. Gerai žinoma, kad visi gyvi organizmai ir net inertiški (negyvi daiktai) yra sudaryti iš materijos, ir tai priklauso nuo cheminių ryšių, kad galėtų susikurti patys.
Priklausomai nuo to, kaip jungiasi atomai ir molekulės, galima nustatyti, koks cheminis ryšys yra apdorojamas, o tarp labiausiai paplitusių galima rasti joninius, kovalentinius ir metalinius ryšius, nors buvo rasti dviejų tipų ryšiai. ryšiai, kurie nėra labai gerai žinomi kalbant apie objektą, tai vandenilio tiltiniai ryšiai ir Van der Waalsas.
Cheminėmis jungtimis vadinamos tos jėgos, dėl kurių du ar daugiau atomų tam tikrą laiką išlieka kartu ir kurios leidžia perduoti elektronus tarp jų.
Tarp dviejų atomų vykstantis traukos procesas virsta kažkuo keistu, tačiau, jei jis analizuojamas su nedideliu dėmesiu, jį galima suprasti labai lengvai. Svarbiausia žinoti, kad teigiamų krūvių turintys branduoliai nutolsta, tačiau tuo pat metu jie gali būti pritraukti dėl jų paviršiuje esančių neigiamai įkrautų elektronų, kurie kelis kartus gali būti didesni už jėgą, kurią sukelia branduoliai nutolti.
Kai cheminis rišimosi procesas vyksta paprastai, jei ne visą laiką kai kurie atomai praranda elektronus o kiti laimi, tačiau proceso pabaigoje tarp visų veiksmų galima pastebėti elektrinį stabilumą.
5 cheminių jungčių tipai
Cheminės jungtys ir kai kurios jų charakteristikos bus parodytos žemiau, kad suprastumėte, kaip jos veikia.

Metalinės nuorodos
Tokio tipo ryšyje galite pamatyti, kaip sukuriamas debesis, kuris laiko visą atomų rinkinį, kurį sudaro laisvieji elektronai. Šiame procese galima pastebėti, kaip atomai virsta elektronais ir jonais, užuot vykę taip, kaip būtų įprasta, paliekant gretimą atomą.
Metalinės jungtys paprastai sudaro kristaliniais laikomus tinklus, kurių koordinacijos indeksas yra aukštas.
Šių tinklų veiduose galite pamatyti tris skirtingus kristalinių tinklų tipus, kurie turi skirtingus koordinavimo taškus, kurie keičiasi priklausomai nuo to, kur jie yra, pasiekdami 12 taškų, 8 taškus ir paskutinius su 6 balais, be to, sakoma, kad metalų atomų valentingumo lygis visada yra mažas.
Joninės jungtys
Kalbėdami apie jonines jungtis, norime nurodyti jungimą tarp atomų, turinčių mažai elektrostatinės energijos, ir tų, kurių to paties tipo energija yra didesnė nei pirmųjų, kurie paprastai yra metalinis ir nemetalinis elementai . Kad tai įvyktų, būtina, kad vienas iš atomų galėtų prarasti elektronus, o kitas juos paeiliui. Todėl šį ryšį galima apibūdinti kaip procesą, kurio metu du atomai turi elektrostatinę trauką, kuriame vienas dalyvauja labiau traukdamas, o kitas mažiau traukia.
Buvo įrodyta, kad nemetalinių elementų sudėtyje nėra elektronų, kad jie galėtų atlikti visą orbitą, ir būtent dėl šios priežasties jis tampa proceso imtuvu, kuris vadinamas anijonu.
Metaliniai elementai yra žinomi kaip katijonai, nes jie turi teigiamą krūvį, kuris yra priešingas anijonams, ir kadangi paskutiniame jų sudėtyje yra elektronas, jie turi galimybę prisijungti prie kitų atomų, šiuo atveju nemetalinių.
Vadovaujantis tuo, kas aprašyta, galima daryti išvadą, kad tokio tipo cheminiame ryšyje atomus traukia elektrostatinė jėga, todėl anijonas pritraukia katijoną, ir tada galima pastebėti, kai vienas iš atomų duoda, o kitas sugeria. Kai šis junginys išlieka kietas, jis išlieka aprašytas ir stabilus, tačiau tiksliai tuo metu, kai jis dedamas į drėgną aplinką arba pagal nutylėjimą kai kuriuose skysčiuose, jie vėl atsiskirtų, išlaikydami savo elektrinius krūvius.
Kovalentiniai ryšiai
Esant kovalentiniams ryšiams, atomai turi galimybę pritraukti ir dalytis elektronais arba juos absorbuoti, kaip ir minėtais atvejais, ir buvo įrodyta, kad jiems įvykus, jonai yra daug stabilesni.
Nors galima sakyti, kad dauguma jungčių gali būti elektros laidininkai, tačiau šiuo atveju paaiškėja, kad didelė dalis nėra. Visa organinė medžiaga susideda iš kovalentinių ryšių, nes, kaip minėta pirmiau, ji yra daug stabilesnė.
Šios obligacijos turi savo padalijimą, kuris skiriasi priklausomai nuo to, ar tai grynas mišinys, ar ne. Jie buvo vadinami poliarinėmis ir nepolinėmis jungtimis, apie kurias žemiau bus pateiktas trumpas paaiškinimas.
Poliarinis kovalentinis ryšys
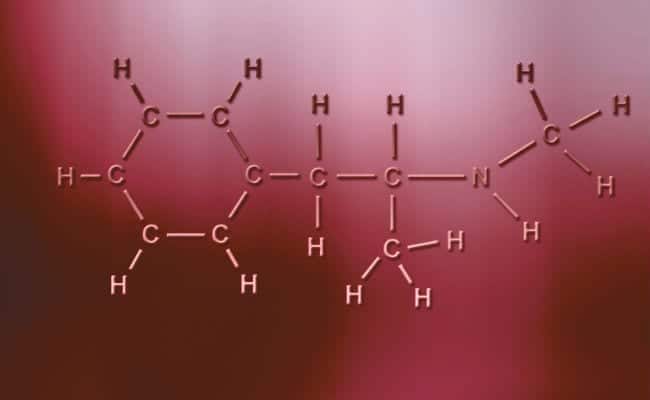
Pagrindinė poliarinių kovalentinių ryšių charakteristika yra ta, kad jie yra visiškai asimetriški ta prasme, kad atomai, turintys teigiamą ar neigiamą krūvį, gali turėti du dalinamus elektronus arba absorbuoti du tarpus, o kiti turi tik vieną, skirtingais atvejais. Tai vyksta praktiškai taip pat, kaip ir joninės jungtys, tačiau vienintelis skirtumas yra tas, kad atomams susijungti atsiranda polinė kovalentinė jungtis. Kad tai įvyktų, jie turi įvykti tarp dviejų visiškai skirtingų nemetalinių elementų,
Nepolinis kovalentinis ryšys
Skirtingai nuo aukščiau aprašyto cheminio ryšio tipo, šiuo atveju turi būti du ar daugiau to paties tipo nemetalo atomų. Tai visiškai skiriasi nuo poliarinio visais atžvilgiais, ir tai galima parodyti žinant, kad kai du to paties elemento atomai dalijasi elektronais, nes procesas yra visiškai simetriškas, jie išlieka subalansuoti ir abu priima ir dovanoja elektronus vienodai.
Vandenilio ryšiai
Vandenilis pasižymi tuo, kad visada turi teigiamą krūvį, ir norint įvykdyti šį ryšį, jį reikia pritraukti prie atomo, turinčio elektronegatyvų krūvį, kuris šio proceso dėka gali stebėti, kaip susidaro jungtis tarp du tas, kuris buvo pavadintas kaip vandenilio tiltas, iš kurio kilo obligacijos pavadinimas.
Nuorodos į Van der Waalsą
Šio tipo jungtyje galima rasti ryšį tarp dviejų nuolatinių dipolių, taip pat tarp dviejų sukeltų dipolių, arba gali būti galimybė, kad bus rasta sąsajų tarp nuolatinio ir sukelto dipolio. Vienintelis būdas tai įvykti yra tarp dviejų simetriškų molekulių, kurios pradeda veikti, kai tarp molekulių yra trauka ar atstūmimas arba pagal nutylėjimą sąveika tarp jonų ir molekulių.
Dėka nuolatinių tyrimų taikoma visoms esamų cheminių jungčių rūšims yra tai, kad buvo galima šiek tiek daugiau suprasti, kaip veikia materija ir kaip ją galima paversti visiškai nauju produktu arba grįžti į savo formą pakeitus elektronų mainų veiksmą, kaip aprašyta daugumoje šių procesų.
Visos šios žinios buvo pasiektos tobulėjant technologijoms, nes anksčiau buvo spėliojama tik apie atomų egzistavimą ir to pavyzdys yra didžiųjų filosofinių mąstytojų atominių modelių egzistavimas, nors jie nebuvo taip toli nuo to, kas yra žinomas šiandien, šiandien buvo įmanoma geriau suprasti procesus.