Matērija sastāv no mazām cilvēka acij neredzamām daļiņām, kuras sauc par atomiem un molekulām, kas ir galvenie komponenti tam, ko mēs šodien zinām kā matēriju.
Iepriekš minētās daļiņas parasti ir uzsākt savienošanas procesu, kas pazīstams kā ķīmiskais savienojums, un tos pēta ķīmija, lai izprastu tūkstošiem bioloģisko procesu, kas katru dienu notiek mūsu priekšā, bet kurus nevar viegli uztvert. Tieši caur viņiem ir saprasta lielākā daļa notikumu, kas pasauli padara tādu, kāda tā ir.
Kas ir ķīmiskās saites?

Visas pasaulē esošās lietas, tostarp dzīvās būtnes, kuru vidū ir arī cilvēki, sastāv no dažu atomu un molekulu savienojuma, kas nolemj pievienoties, izmantojot procesu, kas pazīstams kā ķīmiska saite. Ir labi zināms, ka visi dzīvie organismi un pat inertie (nedzīvie priekšmeti) sastāv no matērijas, un tas ir atkarīgs no ķīmiskajām saitēm, lai spētu sevi izveidot.
Atkarībā no tā, kā atomi un molekulas ir savienoti, ir iespējams noteikt, kāda veida ķīmiskā saite tiek apstrādāta, un starp visbiežāk sastopamajām var atrast jonu, kovalentās un metāliskās saites, lai gan divu veidu jaunas saites, kas nav ļoti labi zināms, kad runa ir par tēmu, kas ir ūdeņraža tilta saites un Van der Vāls.
Par ķīmiskajām saitēm sauc tos spēkus, kas liek diviem vai vairākiem atomiem noteiktu laiku palikt kopā un kas ļauj pārnest elektronus starp tiem.
Piesaistes process, kas notiek starp abiem atomiem, ir kaut kas nedaudz dīvains, bet, ja to analizē ar nelielu uzmanību, to var saprast ļoti viegli. Galvenais, kas jāzina, ir tas, ka kodoli, kuriem ir pozitīvi lādiņi, attālinās, bet tajā pašā laikā tos var piesaistīt, pateicoties elektroniem ar negatīvu lādiņu, kas atrodas uz to virsmas, kas vairākkārt var būt lielāks par spēku, ko tas rada izraisa kodolu attālināšanos.
Kad ķīmiskās saites process notiek parasti, ja ne visu laiku daži atomi zaudē elektronus kamēr citi uzvar, bet procesa beigās starp visām darbībām var novērot elektrisko stabilitāti.
Pieci ķīmisko saišu veidi
Ķīmiskās saites un dažas to īpašības tiks parādītas zemāk, lai saprastu, kā tās darbojas.

Metāla saites
Šāda veida saitēs jūs varat redzēt, kā tiek izveidots mākonis, kas satur visu atomu kopu kopā, kuru veido brīvie elektroni. Šajā procesā var novērot, kā atomi tiek pārveidoti par elektroniem un joniem, nevis notiek tā, kā tas parasti notiek, atstājot blakus esošu atomu.
Metāliskās saites parasti veido kristāliskus tīklus, kuriem ir augsts koordinācijas indekss.
Šo tīklu sejās jūs varat redzēt trīs dažādus kristālisko tīklu veidus, kuriem ir dažādi koordinācijas punkti, kas mainās atkarībā no tā, kur tie atrodas, sasniedzot 12 punktus, 8 punktus un pēdējo ar 6 punktiem, bez Tomēr tiek teikts, ka metāla atomu valences līmenis vienmēr ir mazs.
Jonu saites
Kad mēs runājam par jonu saitēm, mēs vēlamies atsaukties uz savienojumu starp atomiem, kuriem ir maz elektrostatiskās enerģijas, ar tiem, kuru tāda paša veida enerģija ir lielāka nekā pirmajiem, kas parasti ir metāla elements un nemetālisks elements . Lai tas notiktu, ir nepieciešams, lai viens no atomiem varētu zaudēt elektronus, bet otrs tos varētu iegūt secīgi. Tāpēc šo saiti var raksturot kā procesu, kurā diviem atomiem ir elektrostatiskā pievilcība, kurā viens piedalās ar lielāku pievilcību, bet otrs ar mazāku pievilcību.
Tika parādīts, ka nemetāliskiem elementiem to sastāvā trūkst elektrona, lai tiem būtu pilnīga orbīta, un tieši tāpēc tas kļūst par procesa uztvērēju, ko sauc par anjonu.
Metāliskie elementi ir pazīstami kā katijoni, jo tiem ir pozitīvs lādiņš, kas ir pretējs anjoniem, un, tā kā to pēdējā sastāvā ir elektrons, tiem ir iespēja saistīties ar citiem atomiem, šajā gadījumā nemetāliskiem.
Vadoties pēc aprakstītā, var secināt, ka šāda veida ķīmiskajā saitē atomus piesaista elektrostatiskais spēks, un tāpēc anjons piesaista katjonu, un tas ir tur, kad to var novērot, kad viens no atomiem dod ražu kamēr otrs absorbē. Kad šis savienojums paliek ciets, tas paliek aprakstīts un stabils, bet precīzā brīdī tas tiek ievietots mitrā vidē vai pēc noklusējuma kādā šķidrumā, tie atkal atdalītos, saglabājot elektriskos lādiņus.
Kovalentās saites
Kovalentās saitēs atomiem ir iespēja piesaistīt un dalīties ar elektroniem vai absorbēt tos tāpat kā iepriekš minētajos gadījumos, un ir pierādīts, ka tad, kad tie notiek, joni ir daudz stabilāki.
Lai gan var teikt, ka lielākajai daļai saišu ir spēja būt elektrības vadītājiem, taču šajā gadījumā izrādās, ka liela daļa nav. Visu organisko vielu veido kovalentās saites, jo, kā minēts iepriekš, tā ir daudz stabilāka.
Šīm saitēm ir savs dalījums, kas mainās atkarībā no tā, vai tas ir tīrs maisījums vai nē, kurus sauca par polārajām un nepolārajām saitēm, par kurām zemāk tiks sniegts īss paskaidrojums.
Polārā kovalentā saite
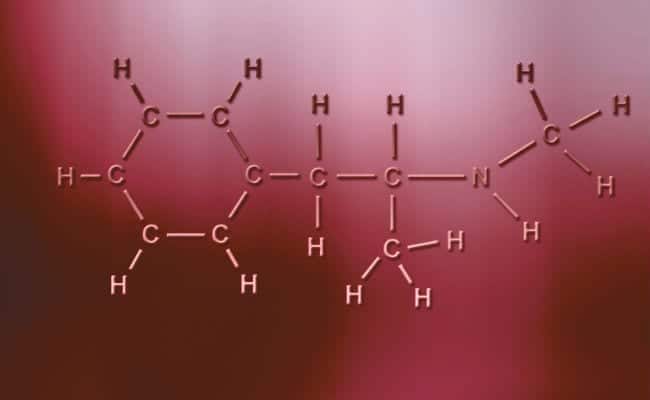
Polāro kovalento saišu galvenā iezīme ir tā, ka tās ir pilnīgi asimetriskas tādā ziņā, ka atomiem ar pozitīvu vai negatīvu lādiņu var būt divi koplietojami elektroni vai divas absorbējamas vietas, bet otram ir tikai viens, mainoties gadījumiem. Tās notiek praktiski tāpat kā jonu saites, bet ar vienīgo atšķirību - lai atomi apvienotos, rodas polārā kovalentā saite. Lai tās notiktu, tām jānotiek starp diviem pilnīgi atšķirīgiem nemetāliskiem elementiem,
Nepolāra kovalentā saite
Atšķirībā no iepriekš aprakstītā ķīmiskās saites veida šajā gadījumā ir jābūt diviem vai vairāk viena veida nemetāla atomiem. Tas pilnīgi atšķiras no polārā visādā ziņā, un to var pierādīt, zinot, ka tad, kad diviem viena elementa atomiem ir kopīgi elektroni, jo process ir pilnīgi simetrisks, tie paliek līdzsvaroti un abi saņem un ziedo elektronus vienādi.
Ūdeņraža saites
Ūdeņradim raksturīgs vienmēr pozitīvs lādiņš, un, lai veiktu šo saiti, ir nepieciešams, lai to piesaista atoms ar elektronegatīvu lādiņu, kas, pateicoties šim procesam, ļauj novērot, kā starp savienojumu veidojas savienojums. divi - tas, kas tika apzīmēts kā ūdeņraža tilts, no kura rodas saites nosaukums.
Saites uz Van der Valsu
Šāda veida saitēs var atrast savienību starp diviem pastāvīgiem dipoliem, kā arī starp diviem inducētiem dipoliem, vai arī pastāv iespēja, ka savienojumi tiks atrasti starp pastāvīgu un inducētu dipolu. Vienīgais veids, kā tas notiek, ir starp divām simetriskām molekulām, kuras sāk darboties, kad starp molekulām ir pievilcība vai atgrūšanās vai pēc noklusējuma mijiedarbība starp joniem un molekulām.
Pateicoties pastāvīgajam pētījumam, kas attiecas uz visu veidu esošajām ķīmiskajām saitēm ir tas, ka ir bijis iespējams nedaudz vairāk saprast, kā matērija darbojas un kā to var pārveidot par pilnīgi jaunu produktu vai atgriezties pie savas formas pēc izmaiņām elektronu apmaiņas darbībā, kā aprakstīts lielākajā daļā šo procesu.
Visas šīs zināšanas ir sasniegtas, pateicoties tehnoloģiju attīstībai, jo iepriekš tās tika spekulētas tikai par atomu esamību, un to piemērs ir izcilu filozofisko domātāju atomu modeļu esamība, kaut arī tie nebija tik tālu no tā, kas ir zināms šodien, šodien ir bijis iespējams labāk izprast procesus.