Materie består av små partiklar som är osynliga för det mänskliga ögat, som kallas atomer och molekyler som är huvudkomponenterna i det vi idag vet som materia.
De ovannämnda partiklarna är vanligtvis in i en bindningsprocess som kallas kemisk bindningoch dessa studeras av kemi för att förstå de tusentals biologiska processer som sker dagligen framför oss men som inte lätt kan uppfattas. Det är genom dem de har lyckats förstå de flesta av de händelser som gör världen som den är.
Vad är kemiska bindningar?

Alla befintliga saker i världen inklusive levande varelser, bland vilka människor, består av föreningen av vissa atomer och molekyler som beslutar att gå med genom en process som kallas en kemisk bindning. Det är välkänt att alla levande organismer och till och med inerta (livlösa föremål) består av materia, och detta beror på kemiska bindningar för att kunna skapa sig själv.
Beroende på hur atomerna och molekylerna förenas är det möjligt att bestämma vilken typ av kemisk bindning som behandlas, och bland de vanligaste kan man hitta joniska, kovalenta och metalliska bindningar, även om två typer av bindningar har hittats. bindningar som inte är särskilt kända när det gäller ämnet, som är vätebrobindningar och Van der Waals.
Kemiska bindningar kallas de krafter som gör att två eller flera atomer stannar tillsammans under en viss tid och som möjliggör överföring av elektroner mellan dem.
Attraktionsprocessen som inträffar mellan de två atomerna i något lite konstigt men som om det analyseras med lite uppmärksamhet kan förstås mycket lätt. Det viktigaste att veta är att kärnorna som har positiva laddningar rör sig bort, men samtidigt kan de attraheras tack vare de negativt laddade elektronerna som finns på ytan, som vid flera tillfällen kan vara större än den kraft som den orsakar kärnorna att flytta bort.
När den kemiska bindningsprocessen sker vanligtvis, om inte hela tiden vissa atomer förlorar elektroner medan andra vinner, men i slutet av processen kan en elektrisk stabilitet observeras mellan alla åtgärder.
De 5 typerna av kemiska bindningar
De kemiska bindningarna och några av deras egenskaper visas nedan för att förstå hur de fungerar.

Metallänkar
I denna typ av bindning kan du se hur ett moln skapas som håller hela uppsättningen atomer samman, som bildas av de lösa elektronerna. Det kan observeras i denna process hur atomerna omvandlas till elektroner och joner, istället för att hända som det normalt skulle vara, lämnar en närliggande atom.
Metallbindningar bildar vanligtvis nätverk som betraktas som kristallina, som har ett högt koordinationsindex.
På ansikten på dessa nätverk kan du se tre olika typer av kristallina nätverk, som har olika koordineringspunkter som ändras beroende på var de är, når 12 poäng, 8 poäng och den sista med 6 poäng, utan det sägs dock att valensnivån för metallatomer är alltid liten.
Joniska bindningar
När vi talar om jonbindningar, vill vi hänvisa till föreningen mellan atomer som har liten elektrostatisk energi med de som har en energi av samma typ större än de första, som vanligtvis är ett metallelement och ett icke-metalliskt element . För att detta ska hända är det nödvändigt att en av atomerna kan förlora elektroner och att den andra kan få dem i följd. Därför kan denna bindning beskrivas som en process där två atomer har en elektrostatisk attraktion, där en deltar med större attraktion och den andra med mindre attraktion.
Det visades att icke-metalliska element saknar en elektron i sin sammansättning för att kunna ha sin fullständiga bana och det är av den anledningen att det blir en mottagare av processen, som kallas en anjon.
Metallelement kallas katjoner eftersom de har en positiv laddning som är motsatsen till anjoner, och eftersom de har en elektron i sin sista komposition har de förmågan att binda till andra atomer, i detta fall icke-metalliska.
Styrt av det som har beskrivits kan man dra slutsatsen att atomerna i denna typ av kemisk bindning lockas av en elektrostatisk kraft, och därför drar anjonen katjonen, och det är då den kan observeras när en av atomerna ger sig medan den andra absorberar. När denna förening förblir fast förblir den som beskriven och stabil, men i det exakta ögonblicket den placeras i en fuktig miljö eller som standard i en viss vätska, skulle de separera igen och bibehålla sina elektriska laddningar.
Kovalenta bindningar
I kovalenta bindningar har atomer förmågan att attrahera och dela elektroner eller absorbera dem som i de ovan nämnda fallen, och det har visats att jonerna är mycket mer stabila när dessa inträffar.
Även om det kan sägas att de flesta länkar har kapacitet att leda elektricitet, men i detta fall visar det sig att en stor del inte är det. Allt organiskt material består av kovalenta bindningar, eftersom det som nämnts ovan är mycket mer stabilt.
Dessa bindningar har sin egen uppdelning som varierar beroende på om det är en ren blandning eller inte, som har kallats polära bindningar och icke-polära bindningar, varav en kort förklaring ges nedan.
Polär kovalent bindning
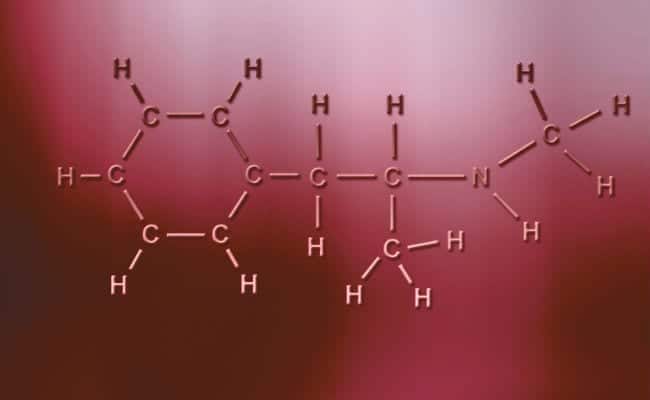
Huvudegenskapen för polära kovalenta bindningar är att de är helt asymmetriska, i den meningen att atomer med en positiv eller negativ laddning kan ha två elektroner att dela eller två utrymmen att absorbera medan den andra bara har en, varierande fall. Dessa händer praktiskt taget samma som jonbindningar men med den enda skillnaden att för atomerna att förenas uppstår en polär kovalent bindning. För att dessa ska inträffa måste de förekomma mellan två helt olika icke-metalliska element,
Icke-polär kovalent bindning
Till skillnad från den typ av kemisk bindning som beskrivs ovan måste det i detta fall finnas två eller flera atomer av en icke-metall av samma typ. Detta skiljer sig helt från polar på alla sätt, och detta kan demonstreras genom att veta att när två atomer av samma element delar elektroner eftersom processen är helt symmetrisk, förblir de balanserade och båda tar emot och donerar elektroner lika.
Vätebindningsbindningar
Väte kännetecknas av att det alltid har en positiv laddning, och för att genomföra denna bindning är det nödvändigt att det lockas till en atom med en elektronegativ laddning, vilket tack vare denna process är det möjligt att observera hur en union bildas mellan två. den som betecknades som en vätgasbro där namnet på bindningen härstammar.
Länkar till Van der Waals
I denna typ av länkar kan föreningen mellan två permanenta dipoler hittas, liksom mellan två inducerade dipoler, eller det kan finnas möjligheten att fackföreningar kommer att hittas mellan en permanent och en inducerad dipol. Det enda sättet för detta att ske är mellan två symmetriska molekyler, som börjar verka när det finns en attraktion eller avstötning mellan molekyler eller som standard interaktionen mellan joner och molekyler.
Tack vare den ständiga studien som gäller alla typer av befintliga kemiska bindningar är att det har varit möjligt att förstå lite mer hur materia fungerar och hur den kan omvandlas till en helt ny produkt eller återgå till sin form efter att ha förändrats i en elektronutbytesåtgärd som beskrivs i de flesta av dessa processer.
All denna kunskap har uppnåtts tack vare den framsteg som tekniken har gjort, eftersom tidigare bara atomer förekom spekulerades och ett exempel på detta är förekomsten av atommodeller hos stora filosofiska tänkare, även om de inte var så långt ifrån vad som är känt idag, idag har det varit möjligt att bättre förstå processerna.