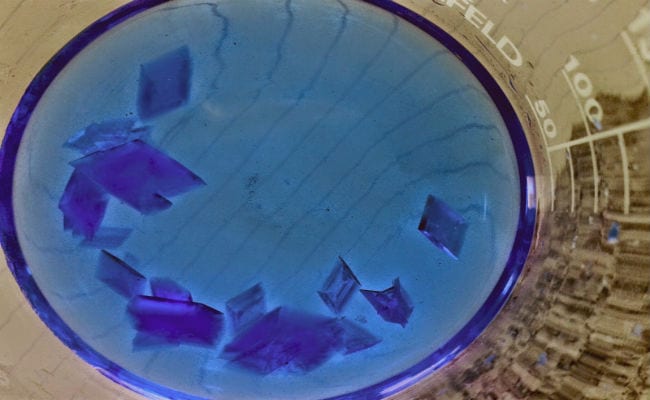
Seguramente has oído alguna vez sobre los cristales, es probable que en este punto tu mente haya visualizado un diamante enorme, una amatista o un topacio. Y ciertamente, dentro de este grupo también se incluyen muchas de las conocidas “piedras preciosas”, pero un cristal no es una denominación que abarque netamente el ámbito de la joyería.
Un cristal es el producto final de un interesante proceso conocido como cristalización, el cual se caracteriza por resultar en un sólido homogéneo formado por “caras”, que son porciones ubicadas en diversos planos.
Características del sólido procedente de la cristalización
El tamaño de un cristal es una característica variable, en un amplio rango de dimensiones. Pueden encontrarse cristales “enormes” los cuales pueden ser medidos a través de la unidad lineal “metro”, así como también podemos encontrar cristales que deben ser expresados en términos de “micras”, ya que su pequeño tamaño los hace comparables con microorganismos como las bacterias, los cuales sólo son observables a través del microscopio.
Como se ha mencionado, los procesos cristalinos derivan en productos de alta pureza, por eso establecimos, anteriormente en la definición, que los cristales son homogéneos: es decir, la composición del producto se mantiene en un valor constante en cualquier punto del volumen del sólido, lo que también implica que las características físicas y químicas permanecen inalterables en toda la pieza, y en caso de observar variación por causa de una perturbación, el cambio se producirá en toda la especie. Esta cualidad, hace de los cristales productos valiosos en diversos ámbitos, que van desde la apreciación de la calidad del material, hasta el uso del proceso de cristalización como técnica para separar sustancias.
Los productos cristalinos, también pueden aislarse a nivel de laboratorio, mediante reacciones controladas en montajes que emulan los procesos espontáneos que ocurren en la naturaleza. Una de las principales ventajas de los cristales obtenidos en procesos controlados, es que presentan formas más regulares, que calzan a la perfección con las figuras poligonales de mayor exactitud.
En un cristal, hay que distinguir las caras que forman parte del hábito cristalino real (características morfológicas), y en base al número de ellas, podemos considerar las formas fundamentales del sólido. Por lo general en un cristal se encuentra definido por la combinación de varias formas fundamentales, siendo las principales son las siguientes:
- Pedión: Cristal constituido por una sola cara plana, sin equivalentes.
- Pinacoide: Se constituye de dos caras equivalentes entre ellas respecto a un eje de simetría.
- Esfenoide: Las dos caras equivalentes que conforman este sólido se encuentran en torno a un eje binario.
- Prisma: Está formado por caras homólogas que constituyen una zona. Siendo la “zona de un cristal” definida como un conjunto de caras paralelas a una misma dirección, correspondiendo a una arista del mismo.
La estructura de los cristales desde un punto de vista interno puede considerarse que está constituida por un sistema más o menos homogéneo, periódico y anisótropo, de un material disuelto que desarrolla una estructura en diversos puntos del espacio. Dentro de las características de los cristales, siempre ha despertado el interés el hecho de que cada punto tenga una repetición periódica en el espacio ocupado por el material. En cristalografía, el fenómeno que influencia esta acción se denomina traslación.
Proceso de cristalización
Para que ocurra una cristalización, debemos partir de una sustancia que pueda catalogarse como “cristalina”, y esto viene definido porque las partículas que la conforman bien sean de naturaleza atómica, molecular o iónica, presentan propiedades de homogeneidad, periodicidad y simetría.
Todo el proceso se activa cuando en algún punto de la sustancia cristalina, las partículas empiezan a reorganizarse, en una etapa que se conoce como nucleación. Todo este proceso involucra, además de la evidente variación en el orden de las partículas, un proceso de cambio en las condiciones termodinámicas, las cuales están orientadas a la compensación de las perturbaciones generadas por el cambio en la energía libre de Gibbs, el cual está marcado por tres sucesos:
- El cambio en la energía química.
- La creación de una interfase entre la zona de la nucleación y el resto de la fase homogénea.
- La variación del volumen y forma que involucra este proceso, desencadena tensiones.
La siguiente fase, se origina, cuando la estructura base de la nucleación se estabiliza. El paso siguiente, es algo lógico y predecible, una vez tenemos la estructura básica entraremos en un proceso de crecimiento, en el cual se observa un cambio de las dimensiones del núcleo. Poco a poco, ese aumento se traducirá en la formación de caras, hasta que el cristal adquiera un hábito bien definido.
Mecanismo del crecimiento de un cristal
La teoría desarrollada por Volmer explica cómo se lleva a cabo el crecimiento de un cristal, estableciendo que, en torno a la estructura básica procedente de la nucleación de la sustancia cristalina, se desarrolla una especie de capa de absorción, la cual actúa como interfase, y adicional a esto promueve una migración en torno a ella de partículas, que se mueven en forma paralela a la superficie. El resultado de este proceso se define como una estructura definida en un plano de dos dimensiones.
Por su parte Kossel y Straski, determinaron que se requiere de un trabajo mecánico para lograr la fijación de un ion a la superficie de esta capa, y que el mismo depende de su posición.
El desarrollo de un modelo que defina el crecimiento, requiere de la previsión de zonas de saturación donde se observa una mayor tasa de cambio (zonas locales de sobresaturación). Esto evidencia que el crecimiento del cristal ocurre por capas.
La cristalización como mecanismo de separación
Dado que un cristal se forma con una sustancia homogénea, se ha extendido su uso como método de separación selectiva de sustancias, entre varios métodos, a continuación, explicaremos en qué consisten aquellos cuyo uso es más extendido:
- Adición de un nuevo solvente: Si conocemos la naturaleza de los productos que estamos manejando, podemos aplicar este método, el cual consiste básicamente en la adición de un nuevo solvente que interactúe con el solvente en el que se encuentra inmerso el soluto que deseamos que cristalice. Cuando el nuevo solvente, selectivamente empieza a interactuar con su homólogo, el soluto precipita, iniciándose el proceso de cristalización.
- Enfriamiento a altas concentraciones de soluto: Cuando tenemos una solución de alta concentración, que fue elaborada a altas temperaturas, y la sometemos a un proceso de enfriamiento, obtenemos una condición de sobresaturación, en la que se tiene disuelta una mayor cantidad de soluto que la que el solvente puede aceptar, en esas nuevas condiciones de temperatura. Si el proceso de reducción en la temperatura se hace en forma controlada, podemos influir sobre el tamaño del cristal que vamos a obtener.
- Sublimación: Esta técnica sólo puede aplicarse en compuestos cristalinos que presenten una elevada presión de vapor, de tal manera que las transformaciones desde una fase gaseosa a una sólida, no requieren el paso por el punto de fusión.