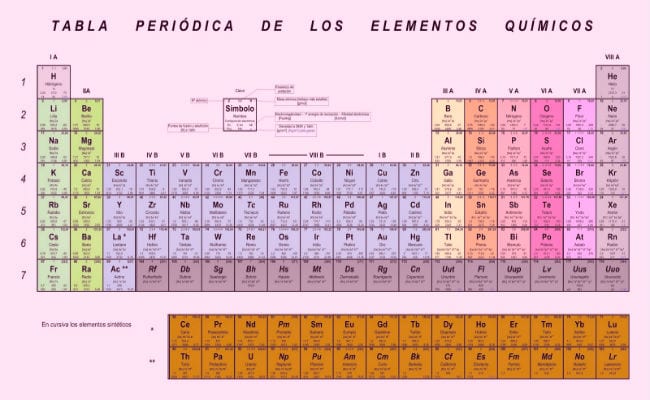
Uno de los grandes logros a nivel científico fue la clasificación y organización de los elementos. El estudio de las propiedades de la materia, se remonta al tiempo de los alquimistas, los científicos de esta área siempre tuvieron presente la importancia de establecer un sistema de clasificación, que permitiera el manejo ordenado de los elementos que se tenían en conocimiento en esa época.
De ahí, luego de muchos intentos, se desarrolló la conocida tabla de electronegatividades, también conocida como la tabla periódica de Mendeléiev, la cual es el sistema más eficiente de clasificación y organización con el que hasta ahora contamos. En ella los elementos se encuentran dispuestos en función de sus electronegatividades, que es son medida de la capacidad de combinación de los electrones de su última capa con otros átomos, pero ya hablaremos de eso.
¿Qué es la electronegatividad?
Antes de entrar de lleno en el tema, es importante aclarar que toda la materia se encuentra conformada por átomos, tal como lo definió John Dalton en 1803. El átomo es la unidad elemental e indivisible de la materia, el cual consiste de un núcleo, en torno al que giran en órbitas elípticas electrones y protones, y son los electrones presentes en la última capa del elemento en su estado de agregación lo que determina la capacidad de cada material para formar compuestos. Esto es lo que define la electronegatividad, la posibilidad del átomo para hacer combinación mediante enlaces con otros átomos.
Este proceso se encuentra definido por la acción de dos magnitudes:
- Masa atómica: Que es la masa total de protones y neutrones en un solo átomo.
- Electrones de valencia: Partículas con carga negativa ubicada en la última capa del átomo, que constituyen la cantidad de partículas disponibles para realizar el intercambio en la formación de compuestos.
Desarrollo de la tabla de electronegatividades
En su búsqueda de una adecuada clasificación de los elementos, muchos científicos desarrollaron ideas en torno a lo que podría resultar un sistema adecuado, a través del cual se pudiera acceder a los elementos en una forma ordenada, tomando en consideración sus propiedades. Los siguientes científicos realizaron aportes importantes que contribuyeron al desarrollo de la actual tabla de electronegatividades:
- Antoine Lavoisier: La clasificación realizada por este científico de los elementos, fue realizada en forma arbitraria, sin tomar en cuenta ningún criterio de clasificación, por lo que su clasificación no tuvo gran éxito.
- Johann Dobereiner: Este científico es conocido por el desarrollo de las triadas que llevan su nombre. Desarrolló un estudio en el que agrupó elementos en grupo de tres, encontrando al hacer comparaciones que las sus masas atómicas relativas (las cuales se determinan usando un espectrómetro de masa), y ciertos valores de sus propiedades físicas, guardaban relación entre sí. Por ello podían predecirse por medio de aproximaciones matemáticas. El químico británico John Newlands, trabajó sobre la base desarrollada por Dobereiner, y así consiguió ordenar los elementos en una tabla con agrupaciones de elementos de masas atómicas relativas en forma creciente; con esta agrupación, el británico buscaba desarrollar una tabla donde se desarrollara un patrón de repeticiones periódicas de las propiedades físicas de los elementos. Dado que tales repeticiones fueron agrupadas en torno a 8 elementos, se les denotó con el nombre de “ley de las octavas”.
- Lothar Meyer: Se le conoce por ampliar el conocimiento en el campo del estudio de la relación de las propiedades físicas y las propiedades atómicas de los componentes. Su trabajo fue complementario, y a su vez independiente del trabajo elaborado por Mendeléiev.
- Dmitri Mendeléiev: Basándose en los postulados de la ley periódica, este científico desarrolló el trabajo de clasificación de elementos más acertado, y que aún sigue estando en vigencia (con modificaciones, en las que se han adicionado los nuevos elementos descubiertos. Clasificó los elementos tomando en cuenta sus electronegatividades, y tuvo la visión de dejar casillas donde no encajaba ningún elemento, previendo que ahí encajaría un elemento que aún no había sido descubierto. Los elementos conocidos que escapaban de parámetros de orden fueron anotados aparte, en lugar de ser incluidos en forma arbitraria (error cometido por Lavoisier y Newlands). En lo que respecta a la electronegatividad dentro de la tabla, se tiene por regla general: La electronegatividad es un valor que se incrementa en la medida que nos desplazamos a la derecha de la tabla, observando un descenso al desplazarse a la izquierda. Los elementos que se encuentran en la parte superior de la tabla, presentan valores de electronegatividad más altos.
Escalas de electronegatividades
Los diferentes valores de la electronegatividad determinan el tipo de enlace formado, por ello, fue objeto del interés el estudio de este proceso, y de desarrollaron dos postulados:
Escala de Pauling: Según los estudios de Pauling, se estableció que la electronegatividad es una propiedad variable, puesto que depende del estado de oxidación del elemento. Sus observaciones permitieron determinara que, si se efectuaba una resta, o diferencia, de las electronegatividades, podíamos predecir el tipo de enlace que se formaría, ya que el estableció una escala:
- Enlace iónico: Gradiente de electronegatividad superior o igual a 1.7. Este enlace usualmente ocurre entre elementos metálicos y no metálicos.
- Enlace covalente: Cuando la diferencia se encuentra en el intervalo de 1.7 a 0.4. Es común verlos en compuestos no metálicos.
- Enlace polar: Para diferencias iguales o inferiores a 0.4.
Escala de Mulliken: Está basada en la afinidad electrónica de los elementos, que define su tendencia a adquirir carga negativa, que es lo que define la capacidad de aceptar electrones de un elemento. También trabaja con los potenciales iónicos, que por su parte determinan la predisposición del elemento a tomar una carga positiva (los elementos con carga positiva son aquellos que donan electrones de su última capa). Esta escala trabaja con valores promedio.